Remicade
Oplysningerne På Webstedet Er Ikke Medicinsk Rådgivning. Vi Sælger Ikke Noget. Nøjagtigheden Af Oversættelsen Er Ikke Garanteret. Ansvarsfraskrivelse
Resume af lægemiddeloversigt
Hvad er Remicade?
Remicade (infliximab) er en kimær IgG1K Monoklonalt antistof bruges til behandling reumatoid arthritis Psoriasis arthritis Ulcerøs colitis Crohns sygdom og Ankyloserende spondylitis . Remicade bruges også til behandling af alvorlig eller deaktiverende Plaque psoriasis (hævet sølvfarvet flager af huden). Remicade bruges ofte, når andre lægemidler ikke har været effektive. Remicade blokerer handlingen af et protein i din krop kaldet Tumor nekrose faktor -alfa (TNF-alfa).
Hvad er bivirkninger af remicade?
Remicade kan forårsage alvorlige bivirkninger, herunder:
- svimmelhed
- kvalme
- fyrede
- kløende eller prikken
- åndenød
- hovedpine
- feber
- kulderystelser
- Muskel- eller ledssmerter
- Smerter eller tæthed i din hals
- brystsmerter
- problemer med at sluge
- ekstrem træthed
- influenzasymptomer
- hoste
- Hudesymptomer (smertevarme eller rødme)
- Hud ændringer
- nye hudvækster
- Bleg hud
- let blå mærker eller blødning
- hævelse i dit ansigt eller hænder
- Mavesmerter (øverste højre side)
- træthed
- Mørk urin
- Gulning af huden eller øjnene (gulsot)
- Skinudslæt på dine kinder eller arme (forværres i sollys)
- følelsesløshed eller prikken
- synsproblemer
- Svaghed i dine arme eller ben
- kramper (anfald)
- Hud rødme eller skællende pletter
- hævede buler fyldt med pus
- Hævelse af dine ankler eller fødder
- Hurtig vægtøgning
- Natsved
- vægttab
- mavesmerter eller hævelse
- hoste og
- hævede kirtler i dine halsarme eller lysken
Få medicinsk hjælp med det samme, hvis du har nogen af de symptomer, der er anført ovenfor.
Almindelige bivirkninger af remicade inkluderer:
- hovedpine
- mavesmerter
- kvalme
- Snerpet næse
- bihule smerte
- hududslæt eller
- Skylning (varme rødme eller prikken følelse).
Fortæl din læge, hvis du oplever alvorlige bivirkninger af remicade inklusive:
- smerte or swelling at injection site
- led eller muskelsmerter
- Hævelse af ankler eller fødder
- let blå mærker eller blødning
- Vision ændres
- anfald
- forvirring
- muskelsvaghed
- følelsesløshed og prikken af våben eller ben
- Sommerfuglformet ansigtsudslæt
- brystsmerter
- smerte/redness/swelling of arms or legs
- åndenød or
- Hurtig/langsom/uregelmæssig hjerteslag.
Søg medicinsk behandling eller ring 911 på én gang, hvis du har følgende alvorlige bivirkninger:
- Alvorlige øjensymptomer såsom pludseligt synstab sløret synet tunnel vision øje smerter eller hævelse eller at se haloer omkring lys;
- Alvorlige hjertesymptomer såsom hurtig uregelmæssige eller bankende hjerteslag; flagrende i brystet; åndenød; og pludselig svimmelhed letthed eller udlevering;
- Alvorlig hovedpine forvirring sløret talearm eller ben svaghed problemer med at gå tab af koordination føles ustabil meget stive muskler høj feber voldsom sved eller rysten.
Dette dokument indeholder ikke alle mulige bivirkninger, og andre kan forekomme. Kontakt din læge for yderligere oplysninger om bivirkninger.
Dosering til Remicade
Doseringen af remicade varierer og afhænger af den tilstand, der behandles.
Hvilke stoffer stoffer eller kosttilskud interagerer med remicade?
Andre lægemidler kan interagere med Remicade. Fortæl din læge alle receptpligtige og over-the-counter medicin og kosttilskud, du bruger.
Remicade under graviditet og amning
Under graviditet skal Remicade kun bruges, når det er ordineret. Det er ukendt, om denne medicin passerer til modermælk. Det er usandsynligt, at det skader et ammende spædbarn. Kontakt din læge inden amning.
Yderligere oplysninger
Vores Remicade (Infliximab) bivirkninger Drug Center giver et omfattende overblik over tilgængelige lægemiddelinformation om de potentielle bivirkninger, når du tager denne medicin.
FDA -lægemiddelinformation
- Lægemiddelbeskrivelse
- Indikationer
- Dosering
- Bivirkninger
- Lægemiddelinteraktioner
- Advarsler
- Overdosis
- Klinisk farmakologi
- Medicin vejledning
ADVARSEL
Alvorlige infektioner og malignitet
Alvorlige infektioner
Patienter behandlet med remicade® har en øget risiko for at udvikle alvorlige infektioner, der kan føre til indlæggelse eller død [se ADVARSELS AND FORHOLDSREGLER og Bivirkninger ]. De fleste patienter, der udviklede disse infektioner, tog samtidig immunsuppressiva, såsom methotrexat eller kortikosteroider.
Remicade bør afbrydes, hvis en patient udvikler en alvorlig infektion eller sepsis.
Rapporterede infektioner inkluderer:
- Aktiv tuberkulose inklusive reaktivering af latent tuberkulose. Patienter med tuberkulose har ofte præsenteret for spredt eller ekstrapulmonal sygdom. Patienter skal testes for latent tuberkulose inden remicade -brug og under terapi.12 Behandling af latent infektion bør initieres inden brug af remicade.
- Invasive svampeinfektioner inklusive histoplasmosis coccidioidomycosis candidiasis aspergillosis blastomycosis og pneumocystose. Patienter med histoplasmose eller andre invasive svampeinfektioner kan have formidlet snarere end lokal sygdom. Antigen- og antistofprøvning til histoplasmose kan være negativ hos nogle patienter med aktiv infektion. Empirisk anti-svampebehandling bør overvejes hos patienter, der er i fare for invasive svampeinfektioner, der udvikler alvorlig systemisk sygdom.
- Bakteriel viral og andre infektioner på grund af opportunistiske patogener inklusive Legionella og Listeria.
Risikoen og fordelene ved behandling med Remicade bør overvejes omhyggeligt inden behandling af terapi hos patienter med kronisk eller tilbagevendende infektion.
Patienter skal overvåges nøje for udviklingen af tegn og symptomer på infektion under og efter behandling med REMICADE inklusive den mulige udvikling af tuberkulose hos patienter, der testede negativt for latent tuberkuloseinfektion inden initiering af terapi.
Malignitet
Lymfom og andre maligniteter nogle dødelige er rapporteret hos børn og unge patienter behandlet med TNF -blokkeere inklusive remicade [se ADVARSELS AND FORHOLDSREGLER ].
Postmarkedstilfælde af hepatosplenisk T-celle-lymfom (HSTCL) En sjælden type T-celle-lymfom er rapporteret hos patienter behandlet med TNF-blokkeere inklusive Remicade. Disse tilfælde har haft et meget aggressivt sygdomsforløb og har været dødelig. Næsten alle patienter havde modtaget behandling med azathioprin eller 6-mercaptopurin samtidig med en TNF-blokkering ved eller før diagnosen. Størstedelen af de rapporterede remicadesager har fundet sted hos patienter med Crohns sygdom eller ulcerøs colitis, og de fleste var hos unge og unge voksne mænd.
Beskrivelse til remicade
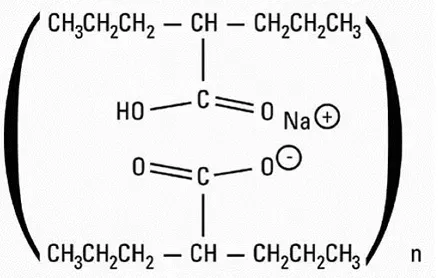
Infliximab Den aktive ingrediens i remicade er et kimært IgG1κ monoklonalt antistof (sammensat af human konstant og murine variable regioner) specifikt for human tumor nekrose faktor-alfa (TNFa). Det har en molekylvægt på ca. 149,1 kilodaltons. Infliximab produceres af en rekombinant cellelinie dyrket af kontinuerlig perfusion og renses af en række trin, der inkluderer foranstaltninger til inaktivering og fjernelse af vira.
Remicade leveres som et sterilt hvidt lyofiliseret pulver til intravenøs infusion. Efter rekonstitution med 10 ml sterilt vand til injektion USP er den resulterende pH ca. 7,2. Hvert enkeltdosis hætteglas indeholder 100 mg infliximab dibasisk natriumphosphatdihydrat (6,1 mg) monobasisk natriumphosphatmonohydrat (2,2 mg) polysorbat 80 (0,5 mg) og sucrose (500 mg). Ingen konserveringsmidler er til stede.
Referencer
1. American Thoracic Society Centers for Disease Control and Prevention. Målrettet tuberculin -test og behandling af latent tuberkulose infektion. Jeg har J Breatar på Crit Med 2000; 161: S221-S247.
2. Se de seneste centre for retningslinjer for sygdomsbekæmpelse og anbefalinger til tuberkulosetest hos immunkompromitterede patienter.
Anvendelser til Remicade
Crohns sygdom
Infliximab er indikeret til:
- Reduktion af tegn og symptomer og induktion og opretholdelse af klinisk remission hos voksne patienter med moderat til alvorligt aktiv Crohns sygdom (CD), der har haft en utilstrækkelig respons på konventionel terapi.
- Reduktion af antallet af dræning af enterokutane og rektovaginale fistler og opretholdelse af fistellukning hos voksne patienter med fistulisering af CD.
Pædiatrisk Crohns sygdom
Infliximab er indikeret til at reducere tegn og symptomer og inducere og opretholde klinisk remission hos pædiatriske patienter 6 år og ældre med moderat til alvorligt aktiv CD, der har haft en utilstrækkelig respons på konventionel terapi.
Ulcerøs colitis
Infliximab er indikeret til reduktion af tegn og symptomer, der inducerer og opretholder klinisk remission og slimhindeheling og eliminering af kortikosteroidbrug hos voksne patienter med moderat til alvorligt aktiv ulcerøs colitis (UC), der har haft en utilstrækkelig respons på konventionel terapi.
Pædiatrisk ulcerøs colitis
Infliximab er indikeret til at reducere tegn og symptomer og inducere og opretholde klinisk remission hos pædiatriske patienter 6 år og ældre med moderat til alvorligt aktiv UC, der har haft en utilstrækkelig respons på konventionel terapi.
Reumatoid arthritis
Infliximab i kombination med methotrexat er indikeret til reduktion af tegn og symptomer, der hæmmer udviklingen af strukturel skade og forbedrer fysisk funktion hos voksne patienter med moderat til alvorligt aktiv reumatoid arthritis (Dag).
Ankyloserende spondylitis
Infliximab er indikeret til reduktion af tegn og symptomer hos voksne patienter med aktiv ankyloserende spondylitis (AS).
Psoriasis arthritis
Infliximab er indikeret til reduktion af tegn og symptomer på aktiv arthritis, der hæmmer udviklingen af strukturel skade og forbedrer fysisk funktion hos voksne patienter med psoriasisartritis (PSA).
Plaque psoriasis
Infliximab er indikeret til behandling af voksne patienter med kronisk alvorlig (dvs. omfattende og/eller deaktiverende) plakspsoriasis (PS), der er kandidater til systemisk terapi, og når andre systemiske terapier er medicinsk mindre passende. Infliximab bør kun administreres til patienter, der vil blive nøje overvåget og have regelmæssige opfølgningsbesøg med en læge [se Bokset advarsel ADVARSELS AND FORHOLDSREGLER ].
Dosering til Remicade
Dosering In Adult Crohns sygdom
Den anbefalede dosering af infliximab er 5 mg/kg givet som et intravenøst induktionsregime ved 0 2 og 6 uger efterfulgt af en vedligeholdelsesregime på 5 mg/kg hver 8. uge derefter til behandling af voksne med moderat til alvorligt aktiv CD eller fistulerende CD. For voksne patienter, der reagerer og derefter mister deres responsovervejelse, kan der gives behandling med 10 mg/kg hver 8. uge. Det er usandsynligt, at patienter, der ikke reagerer i uge 14, reagerer med fortsat dosering og overvejelse for at afbryde infliximab hos disse patienter.
Dosering In Pædiatrisk Crohns sygdom
Den anbefalede dosering af infliximab til pædiatriske patienter 6 år og ældre med moderat til alvorligt aktiv CD er 5 mg/kg givet som et intravenøst induktionsregime ved 0 2 og 6 uger efterfulgt af en vedligeholdelsesregime på 5 mg/kg hver 8. uge.
Dosering In Voksen ulcerøs colitis
Den anbefalede dosering af infliximab er 5 mg/kg givet som et intravenøst induktionsregime ved 0 2 og 6 uger efterfulgt af et vedligeholdelsesregime på 5 mg/kg hver 8. uge derefter til behandling af voksne patienter med moderat til alvorligt aktiv UC.
Dosering In Pædiatrisk ulcerøs colitis
Den anbefalede dosering af infliximab til pædiatriske patienter 6 år og ældre med moderat til alvorligt aktiv UC er 5 mg/kg givet som et intravenøst induktionsregime ved 0 2 og 6 uger efterfulgt af et vedligeholdelsesregime på 5 mg/kg hver 8. uge.
Dosering In Reumatoid arthritis
Den anbefalede dosering af infliximab er 3 mg/kg givet som et intravenøst induktionsregime ved 0 2 og 6 uger efterfulgt af et vedligeholdelsesregime på 3 mg/kg hver 8. uge derefter til behandling af moderat til alvorligt aktiv RA. Infliximab skal gives i kombination med methotrexat. For patienter, der har en ufuldstændig responsovervejelse, kan det gives til at justere doseringen op til 10 mg/kg hver 8. uge eller behandler så ofte som hver 4. uge, der husker, at risikoen for alvorlige infektioner øges ved højere doser pr. Infusion eller hyppigere dosering [se Bivirkninger ].
Dosering In Ankyloserende spondylitis
Den anbefalede dosering af infliximab er 5 mg/kg givet som et intravenøst induktionsregime ved 0 2 og 6 uger efterfulgt af et vedligeholdelsesregime på 5 mg/kg hver 6. uge derefter til behandling af aktiv AS.
Dosering In Psoriasis arthritis
Den anbefalede dosering af infliximab er 5 mg/kg givet som et intravenøst induktionsregime ved 0 2 og 6 uger efterfulgt af et vedligeholdelsesregime på 5 mg/kg hver 8. uge derefter til behandling af PSA. Infliximab kan bruges med eller uden methotrexat.
Dosering In Plaque psoriasis
Den anbefalede dosering af infliximab hos voksne patienter er 5 mg/kg givet som et intravenøst induktionsregime ved 0 2 og 6 uger efterfulgt af et vedligeholdelsesregime på 5 mg/kg hver 8. uge derefter til behandling af kronisk alvorlig (dvs. omfattende og/eller deaktivering) Ps.
Vurdering for latent og aktiv tuberkulose
Før patienterne skal evalueres for aktiv tuberkulose og testes for latent infektion [se med jævne mellemrum under terapi ADVARSELS AND FORHOLDSREGLER ].
Administrationsinstruktioner vedrørende infusionsreaktioner
Før behandling sikrer passende personale og medicin til rådighed til behandling af reaktioner (f.eks. Overfølsomhed andre reaktioner), der forekommer under infusion og kort efter infusion. Før infusion med infliximab-patienter kan der præmes med histamin-1 receptorantagonister histamin-2 receptorantagonister acetaminophen og/eller kortikosteroider [se ADVARSELS AND FORHOLDSREGLER ].
For milde til moderate reaktioner under infusionen skal du overveje at bremse eller stoppe infusionen. Efter opløsning af disse reaktioner kan genindvinding ved en lavere infusionshastighed og/eller med histamin-1 receptorantagonister histamin-2 receptorantagonister acetaminophen og/eller kortikosteroider. Afbryd infusionen, hvis de milde til moderate reaktioner gentages.
Afbryd infusionen, hvis der forekommer alvorlige overfølsomhedsreaktioner under infusionen.
Rekonstitutions fortynding og administrationsinstruktioner
Infliximab er beregnet til brug under vejledning og overvågning af en sundhedsudbyder. Det medfølgende lyofiliserede pulver skal rekonstitueres og fortyndes inden administration. Infusionsløsningen skal fremstilles og administreres af en uddannet medicinsk professionel ved hjælp af aseptisk teknik ved følgende procedure:
*For mængder over 250 ml skal du enten bruge en større infusionspose (f.eks. 500 ml) eller flere 250 ml infusionsposer for at sikre, at koncentrationen af infusionsopløsningen ikke overstiger 4 mg/ml.
- Beregn den samlede dosis -volumen af rekonstitueret infliximab -opløsning krævet og antallet af nødvendige infliximab hætteglas. Mere end et hætteglas kan være nødvendigt for en fuld dosis.
- Rekonstituerer hver 100 mg infliximab hætteglas med 10 ml sterilt vand til injektion USP for at opnå en koncentration på 10 mg/ml under anvendelse af en sprøjte udstyret med en 21-gauge eller mindre nål som følger:
- Fjern flip-top fra hætteglasset, og tør toppen med en alkoholpind.
- Indsæt sprøjten nålen i hætteglasset gennem midten af gummiproppen, og diriger strømmen af sterilt vand til injektion USP til glasvæggen i hætteglasset. Svirre opløsningen forsigtigt ved at dreje hætteglasset for at opløse det lyofiliserede pulver, der har et kage-lignende udseende. Undgå langvarig eller kraftig agitation. Ryst ikke. Skumning af løsningen på rekonstitution er ikke usædvanlig.
- Lad den rekonstituerede løsning stå i 5 minutter. Undersøg visuelt den rekonstituerede løsning for partikler og misfarvning. Den rekonstituerede opløsning skal være farveløs for lysegul og opalescent, og opløsningen kan udvikle et par gennemskinnelige partikler, da infliximab er et protein. Brug ikke, hvis det lyofiliserede pulver ikke har opløst fuldt ud, eller hvis uigennemsigtige partikler misfarvning eller andre udenlandske partikler er til stede. Opbevar ikke ubrugt rekonstitueret infliximab -opløsning.
- Fortynd det samlede volumen af den rekonstituerede infliximab -opløsning til 250 ml* med steril 0,9% natriumchloridinjektion USP (fortynd ikke med noget andet fortyndingsmiddel) som følger:
- Træk et volumen fra 0,9% natriumchloridinjektion USP 250 ml flaske eller taske lig med det samlede volumen af rekonstitueret infliximab, der kræves til en dosis. Tilsæt langsomt det samlede volumen af rekonstitueret infliximab -opløsning fra hætteglas (er) til 250 ml infusionsflasken eller taske.
- Kasser enhver ubrugt del af den rekonstituerede infliximab -opløsning, der er tilbage i hætteglasset.
- Inverter forsigtigt posen for at blande opløsningen. Den resulterende infusionskoncentration skal variere mellem 0,4 mg/ml (minimum anbefalet koncentration) og 4 mg/ml (maksimal anbefalet koncentration) af infliximab.
- Infliximab -infusionen skal begynde inden for 3 timer efter rekonstitution og fortynding. Infusionen skal administreres intravenøst i mindst 2 timer med et infusionssæt med en in-line steril ikke-pyrogen lavt protein-bindende filter (porestørrelse på 1,2 μm eller mindre).
- I betragtning af at hætteglassene ikke indeholder antibakterielle konserveringsmidler kasserer nogen ubrugt del af infusionsopløsningen (opbevares ikke til genbrug).
Ingen fysisk Biokemisk Kompatibilitetsundersøgelser er blevet udført for at evaluere co-administration af infliximab med andre midler. Infliximab bør ikke tilføres samtidig i den samme intravenøse linje med andre midler.
Hvor leveret
Dosering Forms And Strengths
Til injektion : 100 mg infliximab som et hvidt lyofiliseret pulver i et enkeltdosis hætteglas til rekonstitution og fortynding.
Infliximab til injektion leveres som: 100 mg 20 ml hætteglas, der er individuelt pakket i en karton ( NDC 57894-160-01).
Hvert enkeltdosis hætteglas indeholder 100 mg infliximab som en steril konserveringsfri hvidt lyofiliseret pulver til rekonstitution og fortynding (mere end et hætteglas kan være nødvendigt for en fuld dosis) [se Dosering og administration ].
Opbevaring og håndtering
Opbevar uåbnede infliximab hætteglas i et køleskab ved 2 ° C til 8 ° C (36 ° F til 46 ° F).
Om nødvendigt kan uåbnede infliximab hætteglas opbevares ved stuetemperaturer op til maksimalt 30 ° C (86 ° F) i en enkelt periode på op til 6 måneder, men ikke overskrider den oprindelige udløbsdato. Den nye udløbsdato skal skrives i det rum, der er angivet på kartonen. Når det er fjernet fra køleskabet, kan infliximab ikke returneres til køleskabet.
For opbevaringsbetingelser for det rekonstituerede og fortyndede produkt til administration se Dosering og administration .
Fremstillet af: Janssen Biotech Inc. Horsham PA 19044. Revideret: Okt 2021
Bivirkninger for Remicannoncee
Kliniske forsøg oplever
Fordi kliniske forsøg udføres under vidt forskellige tilstande, kan der ikke sammenlignes bivirkninger, der er observeret i de kliniske forsøg med et lægemiddel, ikke direkte med hastigheder i de kliniske forsøg med et andet lægemiddel og muligvis ikke afspejler de satser, der er observeret i praksis.
Bivirkninger hos voksne
De her beskrevne data afspejler eksponering for infliximab hos 4779 voksne patienter (1304 patienter med RA 1106 patienter med CD 202 med AS 293 med PSA 484 med UC 1373 med PS og 17 patienter med andre tilstande) inklusive 2625 patienter udsat for 30 uger og 374 udsat ud over 1 år. [For information om bivirkninger hos pædiatriske patienter se Bivirkninger ]. One of the most-common reasons for discontinuation of treatment was infusion-related reactions (e.g. dyspnea flushing hovedpine og udslæt).
Infusionsrelaterede reaktioner
Bivirkninger under eller kort efter infusion
En infusionsreaktion blev defineret i kliniske forsøg som enhver bivirkning, der forekom under en infusion eller inden for 1 time efter en infusion. I alle de kliniske studier oplevede ca. 20% af infliximab-behandlede patienter en infusionsreaktion sammenlignet med 10% af placebo-behandlede patienter. Af infliximab-behandlede patienter, der havde en infusionsreaktion i induktionsperioden 27%, oplevede en infusionsreaktion i vedligeholdelsesperioden. Af patienter, der ikke havde en infusionsreaktion i induktionsperioden 9%, oplevede en infusionsreaktion i vedligeholdelsesperioden.
Blandt alle infliximab -infusioner blev 3% ledsaget af ikke -specifikke symptomer såsom feber eller kulderystelser 1% blev ledsaget af kardiopulmonale reaktioner (primært brystsmerter Hypotension hypertension eller dyspnø) og <1% were accompanied by pruritus urticaria or the combined symptoms of pruritus/urticaria og cardiopulmonary reactions. Serious infusion reactions occurred in <1% of patients og included anaphylaxis convulsions erythematous udslæt og Hypotension. Approximately 3% of patients discontinued Infliximab because of infusion reactions og all patients recovered with treatment og/or discontinuation of the infusion. Infliximab infusions beyond the initial infusion were not associated with a higher incidence of reactions. The infusion reaction rates remained stable in Ps through 1 year in Ps Study I. In psoriasis Study II the rates were variable over time og somewhat higher following the final infusion than after the initial infusion. Across the 3 Ps studies the percent of total infusions resulting in infusion reactions (i.e. an annonceverse event occurring within 1 hour) was 7% in the 3 mg/kg group 4% in the 5 mg/kg group og 1% in the placebo group.
Patienter, der blev positive for antistoffer til infliximab, var mere sandsynlige (ca. to til tredobbelt) at have en infusionsreaktion end dem, der var negative. Brug af samtidige immunsuppressive midler syntes at reducere hyppigheden af både antistoffer til infliximab og infusionsreaktioner [se Bivirkninger og Lægemiddelinteraktioner ].
Infusionsreaktioner efter readministration
I et klinisk forsøg med patienter med moderat til svær PS designet til at vurdere effektiviteten af langvarig vedligeholdelsesbehandling versus genbehandling med en induktionsregime af infliximab efter sygdomsflare 4% (8/219) af patienter i genbehandlingsinduktionsbehandlingen oplevede alvorlige infusionsreaktioner versus <1% (1/222) in the maintenance therapy arm. Patients enrolled in this trial did not receive any concomitant immunosuppressant terapi. In this study the majority of serious infusion reactions occurred during the second infusion at Week 2. Symptoms included but were not limited to dyspnea urticaria facial edema og Hypotension. In all cases Infliximab treatment was discontinued og/or other treatment instituted with complete resolution of signs og symptoms.
Forsinkede reaktioner/reaktioner efter readministration
I PS-undersøgelser oplevede ca. 1% af infliximab-behandlede patienter en mulig forsinket overfølsomhedsreaktion generelt rapporteret som serumsyge eller en kombination af arthralgi og/eller myalgi med feber og/eller udslæt. Disse reaktioner forekom generelt inden for 2 uger efter gentagne infusion.
Infektioner
I infliximab blev der rapporteret om kliniske undersøgelser af infektioner hos 36% af infliximab-behandlede patienter (gennemsnit på 51 ugers opfølgning) og hos 25% af placebo-behandlede patienter (gennemsnit på 37 ugers opfølgning). De rapporterede infektioner var hyppigst rapporteret luftvejsinfektioner (inklusive bihulebetændelse faryngitis og bronkitis) og urinvejsinfektioner. Blandt infliximab-behandlede patienter inkluderede alvorlige infektioner lungebetændelse cellulitis abscess hud ulceration sepsis og bakteriel infektion. I kliniske forsøg blev der rapporteret om, at der blev rapporteret om opportunistiske infektioner; 2 tilfælde hver af coccidioidomycosis (1 tilfælde var dødelig) og histoplasmosis (1 tilfælde var dødelig) og 1 tilfælde hver af pneumocystose nocardiosis og Cytomegalovirus . Tuberculosis (TB) blev rapporteret hos 14 patienter, hvoraf 4 døde på grund af miliær tuberkulose. Andre tilfælde af TB inklusive formidlet TB er også rapporteret efter markedsføring. De fleste af disse tilfælde af TB forekom inden for de første 2 måneder efter påbegyndelse af terapi med infliximab og kan afspejle rekruttering af latent sygdom [se ADVARSELS AND FORHOLDSREGLER ]. In the 1-year placebo-controlled studies RA I og RA II 5.3% of patients receiving Infliximab every 8 weeks with MTX developed serious infections as compared to 3.4% of placebo patients receiving MTX. Of 924 patients receiving Infliximab 1.7% developed pneumonia og 0.4% developed TB when compared to 0.3% og 0.0% in the placebo arm respectively. In a shorter (22-week) placebo-controlled study of 1082 RA patients rogomized to receive placebo 3 mg/kg or 10 mg/kg Infliximab infusions at 0 2 og 6 weeks followed by every 8 weeks with MTX serious infections were more frequent in the 10 mg/kg Infliximab group (5.3%) than the 3 mg/kg or placebo groups (1.7% in both). During the 54-week Crohn's II Study 15% of patients with fistulizing CD developed a new fistula-related abscess.
I infliximab blev kliniske studier hos patienter med UC-infektioner behandlet med antimikrobielle stoffer rapporteret hos 27% af infliximab-behandlede patienter (gennemsnit 41 ugers opfølgning) og i 18% af placebo-behandlede patienter (gennemsnit 32 ugers opfølgning). De typer infektioner inklusive alvorlige infektioner rapporteret hos patienter med UC svarede til dem, der blev rapporteret i andre kliniske studier.
Begyndelsen af alvorlige infektioner kan foregå med forfatningsmæssige symptomer såsom feber kulderystelser vægttab og træthed. Størstedelen af alvorlige infektioner kan dog også foregå med tegn eller symptomer, der er lokaliseret til infektionsstedet.
Autoantistoffer/Lupus-lignende syndrom
Cirka halvdelen af infliximab-behandlede patienter i kliniske forsøg, som var antinukleære antistof (ANA) negativt ved baseline, udviklede en positiv ANA under forsøget sammenlignet med ca. en femtedel af placebo-behandlede patienter. Anti-dsDNA-antistoffer blev nyligt påvist hos cirka en femtedel af infliximab-behandlede patienter sammenlignet med 0% af placebo-behandlede patienter. Rapporter om lupus og lupus-like syndromes however remain uncommon.
Maligniteter
I kontrollerede forsøg udviklede flere infliximab-behandlede patienter maligniteter end placebo-behandlede patienter [se ADVARSELS AND FORHOLDSREGLER ].
I et randomiseret kontrolleret klinisk forsøg på at undersøge brugen af infliximab hos patienter med moderat til svær KOLS, som enten var nuværende rygere eller ex-rygere, blev 157 patienter behandlet med infliximab i doser svarende til dem, der blev anvendt i RA og CD. Af disse infliximab-behandlede patienter udviklede 9 en malignitet inklusive 1 lymfom for en hastighed på 7,67 tilfælde pr. 100 patientår efter opfølgning (median varighed af opfølgningen 0,8 år; 95% CI 3,51-14,56). Der var 1 rapporteret malignitet blandt 77 kontrolpatienter for en sats på 1,63 tilfælde pr. 100 patientår efter opfølgning (median varighed af opfølgning 0,8 år; 95% Cl 0,04-9,10). Størstedelen af de maligniteter, der er udviklet i lungen eller hovedet og nakken [se ADVARSELS AND FORHOLDSREGLER ].
Bivirkninger hos patienter med NYHA klasse III/IV hjertesvigt
I en randomiseret dobbeltblind undersøgelse, der evaluerer infliximab i moderat eller svær hjertesvigt (NYHA klasse III/IV; venstre ventrikulær ejektionsfraktion ≤35%) 150 patienter blev randomiseret til at modtage behandling med 3 infusioner af infliximab 10 mg/kg 5 mg/kg eller placebo ved 0 2 og 6 uger. Højere forekomster af dødelighed og indlæggelse på grund af forværring af hjertesvigt blev observeret hos patienter, der fik 10 mg/kg infliximab -dosis. Ved 1 år var 8 patienter i 10 mg/kg infliximab -gruppen død sammenlignet med 4 dødsfald hver i 5 mg/kg infliximab og placebogrupperne. Der var tendenser mod forøget dyspnø -hypotension angina og svimmelhed i både 10 mg/kg og 5 mg/kg infliximab -behandlingsgrupper mod placebo. Infliximab er ikke undersøgt hos patienter med mild hjertesvigt (NYHA klasse I/II) [se Kontraindikationer og ADVARSELS AND FORHOLDSREGLER ].
Hepatotoksicitet
Alvorlig leverskade inklusive akut leversvigt og autoimmun hepatitis er rapporteret hos patienter, der får infliximab [se ADVARSELS AND FORHOLDSREGLER ]. Reactivation of hepatitis B virus has occurred in patients receiving TNF blockers including Infliximab who are chronic carriers of this virus [see ADVARSELS AND FORHOLDSREGLER ].
I kliniske forsøg i RA CD UC som PS- og PSA -forhøjelser af aminotransferaser blev observeret (ALT mere almindelige end AST) i en større andel af patienter, der fik infliximab end i kontroller (tabel 1) både når infliximab blev givet som monoterapi, og når det blev anvendt i kombination med andre immunosuppressive agenter. Generelt var patienter, der udviklede ALT- og AST -forhøjninger, asymptomatiske, og abnormiteterne faldt eller løst med enten fortsættelse eller seponering af infliximab eller modifikation af samtidig medicin.
Tabel 1: Andel af patienter med forhøjet ALT i kliniske forsøg hos voksne
| Andel af patienter med forhøjet ALT | ||||||
| > 1 til <3 x ULN | ≥3 x uln | ≥5 x uln | ||||
| Placebo | Infliximab | Placebo | Infliximab | Placebo | Infliximab | |
| Reumatoid arthritisa | 24% | 34% | 3% | 4% | <1% | <1% |
| Crohns sygdomb | 34% | 39% | 4% | 5% | 0% | 2% |
| Ulcerøs colitisc | 12% | 17% | 1% | 2% | <1% | <1% |
| Ankyloserende spondylitisd | 15% | 51% | 0% | 10% | 0% | 4% |
| Psoriasis arthritise | 16% | 50% | 0% | 7% | 0% | 2% |
| Plaque psoriasisf | 24% | 49% | <1% | 8% | 0% | 3% |
| a Placebo patients received methotrexate while Infliximab patients received both Infliximab og methotrexate. Median follow-up was 58 weeks. b Placebo patients in the 2 Phase 3 trials in CD received an initial dose of 5 mg/kg Infliximab at study start og were on placebo in the maintenance phase. Patients who were rogomized to the placebo maintenance group og then later crossed over to Infliximab are included in the Infliximab group in ALT analysis. Median follow-up was 54 weeks. c Median opfølgning var 30 uger. Specifikt var den median varighed af opfølgningen 30 uger for placebo og 31 uger for infliximab. d Median opfølgning var 24 uger for placebogruppen og 102 uger for infliximab-gruppen. e Median opfølgning var 39 uger for infliximab-gruppen og 18 uger for placebogruppen. f ALT-værdier opnås i 2 fase 3 PS-undersøgelser med median opfølgning på 50 uger for infliximab og 16 uger for placebo. |
Bivirkninger i psoriasisundersøgelser
Under den placebo-kontrollerede del over de 3 kliniske forsøg op til uge 16 andelen af patienter, der oplevede mindst 1 alvorlig bivirkning (SAE; defineret som resulterende i døds livstruende kræver hospitalisering eller vedvarende eller signifikant handicap/inhabilitet) var 0,5% i 3 mg/kg infliximab-gruppen 1,9% i placebogruppen og 1,6% i 5 mg/kg inflix-gruppen.
Blandt patienter i 2 -fase 3 -undersøgelser 12,4% af patienterne, der fik infliximab 5 mg/kg hver 8. uge gennem 1 års vedligeholdelsesbehandling, oplevede mindst 1 SAE i undersøgelse I. I undersøgelse II 4,1% og 4,7% af patienterne, der fik infliximab 3 mg/kg og 5 mg/kg hver 8. uge til 1 år med vedligeholdelsesbehandling, oplevede den mindst 1 SAE.
En død på grund af bakteriel sepsis forekom 25 dage efter den anden infusion af 5 mg/kg infliximab. Alvorlige infektioner inkluderede sepsis og abscesser. I undersøgelse I 2,7% af patienterne, der fik infliximab 5 mg/kg hver 8. uge gennem 1 års vedligeholdelsesbehandling, oplevede mindst 1 alvorlig infektion. I undersøgelse II 1,0% og 1,3% af patienterne, der modtog infliximab 3 mg/kg og 5 mg/kg gennem 1 års behandling, oplevede mindst 1 alvorlig infektion. Den mest almindelige alvorlige infektion (krævende indlæggelse) var abscess (hudhals og peri-rektal) rapporteret af 5 (0,7%) patienter i gruppen 5 mg/kg infliximab. To aktive tilfælde af tuberkulose blev rapporteret: 6 uger og 34 uger efter start af infliximab.
I den placebo-kontrollerede del af PS-undersøgelserne 7 af 1123 patienter, der modtog infliximab i enhver dosis, blev diagnosticeret med mindst en NMSC sammenlignet med 0 af 334 patienter, der modtog placebo.
I PS -undersøgelserne oplevede 1% (15/1373) af patienter serumsyge eller en kombination af arthralgi og/eller myalgi med feber og/eller udslæt normalt tidligt i behandlingsforløbet. Af disse patienter krævede 6 hospitalisering på grund af feber alvorlig myalgia arthralgia hævede led og immobilitet.
Andre bivirkninger hos voksne
Sikkerhedsdata er tilgængelige fra 4779 Infliximab-behandlede voksne patienter inklusive 1304 med RA 1106 med CD 484 med UC 202 med AS 293 med PSA 1373 med PS og 17 med andre forhold. [For information om andre bivirkninger hos pædiatriske patienter se Bivirkninger ]. Adverse reactions reported in ≥5% of all patients with RA receiving 4 or more infusions are in Table 2. The types og frequencies of annonceverse reactions observed were similar in Infliximab-treated RA AS PsA Ps og CD patients except for abdominal smerte which occurred in 26% of Infliximab-treated patients with CD. In the CD studies there were insufficient numbers og duration of follow-up for patients who never received Infliximab to provide meaningful comparisons.
Tabel 2: Bivirkninger, der forekom hos ≥ 5% af patienterne, der modtog ≥ 4 infliximab -infusioner for RA
| Placebo (n = 350) | Infliximab (n = 1129) | |
| Gennemsnitlige uger med opfølgning | 59 uger | 66 uger |
| Infektion i øvre luftvejsinfektion | 25% | 32% |
| Kvalme | 20% | 21% |
| Hovedpine | 14% | 18% |
| Bihulebetændelse | 8% | 14% |
| Diarre | 12% | 12% |
| Mavesmerter | 8% | 12% |
| Pharyngitis | 8% | 12% |
| Hoste | 8% | 12% |
| Bronchitis | 9% | 10% |
| Udslæt | 5% | 10% |
| Dyspepsi | 7% | 10% |
| Træthed | 7% | 9% |
| Urinvejsinfektion | 6% | 8% |
| Smerte | 7% | 8% |
| Arthralgia | 7% | 8% |
| Kløe | 2% | 7% |
| Feber | 4% | 7% |
| Hypertension | 5% | 7% |
| Moniliasis | 3% | 5% |
De mest almindelige alvorlige bivirkninger, der blev observeret i kliniske forsøg, var infektioner [se Bivirkninger ]. Other serious medically relevant annonceverse reactions ≥0.2% or clinically significant annonceverse reactions by body system were as follows:
- Krop som helhed: Allergisk reaktionsødem
- Blod: Pancytopenia
- Kardiovaskulær: Hypotension
- Gastrointestinal: Forstoppelse tarmobstruktion
- Central og perifer nervøs: svimmelhed
- Hjerterytme og rytme: Bradycardia
- Lever og galde: hepatitis
- Metabolisk og ernæringsmæssig: dehydrering
- Blødning og koagulation af blodplader: thrombocytopeni
- Neoplasmer: Lymfom
- Røde blodlegemer: Anæmi hæmolytisk anæmi
- Modstandsmekanisme: Cellulitis sepsis serumsyge sarkoidose
- Respiratorisk: Nedre luftvejsinfektion (inklusive lungebetændelse) pleurisy lungeødem
- Hud og vedhæng: øget sved
- Vaskulær (ekstrakardiac): Thrombophlebitis
- Hvid celle og reticuloendothelial: Leukopeni -lymfadenopati
Bivirkninger hos pædiatriske patienter
Bivirkninger hos pædiatriske patienter With Crohns sygdom
Der var nogle forskelle i de bivirkninger, der blev observeret hos de pædiatriske patienter, der fik infliximab sammenlignet med dem, der blev observeret hos voksne med CD. Disse forskelle diskuteres i de følgende afsnit.
Følgende bivirkninger blev rapporteret mere almindeligt hos 103 randomiserede pædiatriske CD -patienter administreret 5 mg/kg infliximab gennem 54 uger end hos 385 voksne CD -patienter, der fik en lignende behandlingsregime: anæmi (11%) leukopeni (9%) skylning (9%) viral infektion (8%) Neutropeni (7%) knoglefraktur (7%) bakterieinfektion (6%) og luftvejsallergisk reaktion (6%).
Infektioner were reported in 56% of rogomized pediatric patients in Study Peds Crohn's og in 50% of annonceult patients in Study Crohn's I. In Study Peds Crohn's infections were reported more frequently for patients who received every 8-week as opposed to every 12-week infusions (74% og 38% respectively) while serious infections were reported for 3 patients in the every 8-week og 4 patients in the every 12-week maintenance treatment group. The most commonly reported infections were upper respiratory tract infection og pharyngitis og the most commonly reported serious infection was abscess. Pneumonia was reported for 3 patients (2 in the every 8-week og 1 in the every 12-week maintenance treatment groups). Herpes zoster was reported for 2 patients in the every 8-week maintenance treatment group.
I undersøgelsen oplevede PEDS Crohns 18% af randomiserede patienter 1 eller flere infusionsreaktioner uden nogen bemærkelsesværdig forskel mellem behandlingsgrupper. Af de 112 patienter i undersøgelsesfæller Crohns var der ingen alvorlige infusionsreaktioner, og 2 patienter havde ikke-alvorlige anafylactoidreaktioner.
Forhøjelser af alt op til 3 gange den øvre grænse for normal (ULN) blev set hos 18% af pædiatriske patienter i CD -kliniske forsøg; 4% havde ALT -forhøjninger ≥3 × ULN og 1% havde forhøjninger ≥5 × Uln. (Median opfølgning var 53 uger).
Bivirkninger hos pædiatriske patienter With Ulcerøs colitis
Generelt var de bivirkninger, der er rapporteret i den pædiatriske UC -forsøg og voksne UC (undersøgelse UC I og undersøgelse UC II) -undersøgelser, generelt konsistente. I et pædiatrisk UC -forsøg var de mest almindelige bivirkninger øvre luftvejsinfektion pharyngitis abdominal smerte feber og hovedpine.
Infektioner were reported in 31 (52%) of 60 treated patients in the pediatric UC trial og 22 (37%) required oral or parenteral antimicrobial treatment. The proportion of patients with infections in the pediatric UC trial was similar to that in the pediatric CD study (Study Peds Crohn's) but higher than the proportion in the annonceults' UC studies (Undersøg uc i og Undersøg uc iI). The overall incidence of infections in the pediatric UC trial was 13/22 (59%) in the every 8 week maintenance treatment group. Infektion i øvre luftvejsinfektion (7/60 [12%]) og pharyngitis (5/60 [8%]) were the most frequently reported respiratory system infections. Serious infections were reported in 12% (7/60) of all treated patients.
Forhøjelser af alt op til 3 gange den øvre grænse for normal (ULN) blev set hos 17% (10/60) af pædiatriske patienter i den pædiatriske UC -forsøg; 7% (4/60) havde ALT-forhøjninger ≥3 × ULN og 2% (1/60) havde forhøjninger ≥5 × ULN (median opfølgning var 49 uger).
Samlet set 8 af 60 (13%) behandlede patienter oplevede en eller flere infusionsreaktioner inklusive 4 af 22 (18%) patienter i hver 8-ugers behandlingsgruppe. Der blev ikke rapporteret om alvorlige infusionsreaktioner.
I det pædiatriske UC -forsøg var 45 patienter i aldersgruppen 12 til 17 år og 15 i aldersgruppen på 6 til 11 år. Antallet af patienter i hver undergruppe er for lille til at gøre nogen endelige konklusioner om alderen af alder på sikkerhedsbegivenheder. Der var højere andele af patienter med alvorlige bivirkninger (40% mod 18%) og seponering på grund af bivirkninger (40% mod 16%) i den yngre aldersgruppe end i den ældre aldersgruppe. Mens andelen af patienter med infektioner også var højere i den yngre aldersgruppe (60% mod 49%) for alvorlige infektioner, var proportioner ens i de to aldersgrupper (13% i aldersgruppen på 6 til 11 år mod 11% i aldersgruppen 12 til 17 år). De samlede proportioner af bivirkninger, inklusive infusionsreaktioner, var ens mellem aldersgrupper 6 til 11 og 12 til 17 år (13%).
Immunogenicitet
Som med alle terapeutiske proteiner er der potentiale for immunogenicitet. Påvisningen af antistofdannelse er meget afhængig af følsomheden og specificiteten af assayet. Derudover kan den observerede forekomst af antistof (inklusive neutraliserende antistof) positivitet i et assay påvirkes af adskillige faktorer, herunder assaymetodologi Prøvehåndteringstidspunkt for prøveopsamling Samtidig medicin og underliggende sygdom. Af disse grunde kan sammenligning af forekomsten af antistoffer i undersøgelsen beskrevet nedenfor med forekomsten af antistoffer i andre undersøgelser eller til andre infliximab -produkter være vildledende.
Behandling med infliximab kan være forbundet med udviklingen af antistoffer til infliximab. En enzymimmunoassay (EIA) -metode blev oprindeligt anvendt til at måle anti-infliximab-antistoffer i kliniske undersøgelser af infliximab. VVM -metoden er genstand for interferens af seruminfliximab, der muligvis resulterer i en undervurdering af hastigheden for dannelse af patientantistof. En separat lægemiddel-tolerant elektrokemiluminescensimmunoassay (ECLIA) -metode til påvisning af antistoffer til infliximab blev derefter udviklet og valideret. Denne metode er 60 gange mere følsom end den originale VVM. Med ECLIA -metoden kan alle kliniske prøver klassificeres som enten positive eller negative for antistoffer til infliximab uden behov for den uomstrækkelige kategori.
Forekomsten af antistoffer til infliximab var baseret på den originale VVM -metode i alle kliniske undersøgelser af infliximab undtagen for fase 3 -undersøgelsen hos pædiatriske patienter med UC, hvor forekomsten af antistoffer til infliximab blev påvist under anvendelse af både EIA og ECLIA -metoderne.
Immunogenicitet In Adult Patients
Forekomsten af antistoffer til infliximab hos patienter med RA og CD fik et 3-dosis-induktionsregime efterfulgt af vedligeholdelsesdosering var ca. 10% som vurderet gennem 1 til 2 års infliximab-behandling. En højere forekomst af antistoffer til infliximab blev observeret hos CD-patienter, der fik infliximab efter lægemiddelfrie intervaller> 16 uger. I en PSA -undersøgelse, hvor 191 patienter modtog 5 mg/kg med eller uden MTX -antistoffer til infliximab, forekom 15% af patienterne. Størstedelen af antistof-positive patienter havde lave titere. Antistofudvikling var lavere blandt RA- og CD-patienter, der fik immunsuppressive terapier, såsom 6-MP/AZA eller MTX. Patienter, der var antistofpositive Bivirkninger ]. In the Ps Study II which included both the 5 mg/kg og 3 mg/kg doses antibodies were observed in 36% of patients treated with 5 mg/kg every 8 weeks for 1 year og in 51% of patients treated with 3 mg/kg every 8 weeks for 1 year.
I PS -undersøgelsen III, som også omfattede både 5 mg/kg og 3 mg/kg doser antistoffer blev observeret hos 20% af patienterne behandlet med 5 mg/kg induktion (uger 0 2 og 6) og hos 27% af patienterne behandlet med 3 mg/kg induktion. På trods af stigningen i antistofdannelse af infusionsreaktionshastighederne i undersøgelser I og II hos patienter behandlet med 5 mg/kg induktion efterfulgt af hver 8. uge vedligeholdelse i 1 år og i undersøgelse III hos patienter behandlet med 5 mg/kg induktion (14,1%-23,0%) og alvorlige infusionsreaktionshastigheder (<1%) were similar to those observed in other study populations. The clinical significance of apparent increased immunogenicity on efficacy og infusion reactions in Ps patients as compared to patients with other diseases treated with Infliximab over the long term is not known.
Immunogenicitet In Pediatric Patients With Crohns sygdom
I undersøgelsen af PEDS Crohns, hvor alle patienter modtog stabile doser af 6-MP AZA eller MTX eksklusive uoverensstemmende prøver 3 af 24 patienter havde antistoffer mod infliximab. Selvom 105 patienter blev testet for antistoffer til infliximab 81 patienter blev klassificeret som uomgængelige, fordi de ikke kunne styres som negativ på grund af analyseinterferens ved tilstedeværelsen af infliximab i prøven.
Immunogenicitet In Pediatric Patients With Ulcerøs colitis
I det pædiatriske UC-forsøg blev 58 patienter evalueret for antistoffer til infliximab under anvendelse af VVM såvel som de lægemiddel-tolerante eclia. Med EIA 4 af 58 (7%) havde patienter antistoffer mod infliximab. Med ECLIA 30 af 58 (52%) havde patienter antistoffer mod infliximab. Den højere forekomst af antistoffer til infliximab ved ECLIA-metoden skyldtes den 60 gange højere følsomhed sammenlignet med VVM-metoden. Mens EIA-positive patienter generelt havde ikke-påviselige truginfliximab-koncentrationer Eclia-positive patienter kunne have påviselige trugkoncentrationer af infliximab, fordi ECLIA-assayet er mere følsom og lægemiddel-tolerant.
Oplevelse af postmarketing
Bivirkninger Nogle med dødelige resultater er blevet identificeret under anvendelse af infliximab efter godkendelse af infliximab hos voksne og pædiatriske patienter. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt at pålideligt estimere deres frekvens eller etablere et årsagsforhold til eksponering for lægemidler.
Postmarkedets bivirkninger hos voksne og pædiatriske patienter
- Neutropeni [se ADVARSELS AND FORHOLDSREGLER ] Agranulococytisis (inklusive spædbørn udsat i utero til infliximab) Idiopatisk thrombocytopenisk purpura Trombotisk thrombocytopenisk purpura .
- Interstitiel lungesygdom (inklusive lungefibrose/interstitiel pneumonitis og hurtigt progressiv sygdom).
- Pericardial effusion systemisk og kutan Vasculitis .
- Erythema multiforme stevens-Johnson syndrom Toksisk epidermal nekrolyse lineær IgA bullous dermatose (LABD) akut generaliseret exanthematous pustulosis (alderssp) nye indtræden og forværring af psoriasis (alle subtypes inklusive pustulær primært palmoplantar) likenoidreaktioner.
- Perifere demyeliniserende lidelser (såsom Guillain-Barré-syndrom kronisk inflammatorisk demyeliniserende polyneuropati og multifokal motorisk neuropati) tværgående myelitis og neuropatier (yderligere neurologiske reaktioner er også observeret) [se ADVARSELS AND FORHOLDSREGLER ].
- Akut leversvigt gulsot hepatitis og cholestasis [see ADVARSELS AND FORHOLDSREGLER ].
- Alvorlige infektioner [se ADVARSELS AND FORHOLDSREGLER ] og vaccine gennembrudinfektion inklusive bovin tuberkulose (formidlet BCG -infektion) efter vaccination i et spædbarn udsat i utero for infliximab [se ADVARSELS AND FORHOLDSREGLER ].
- Maligniteter including leukemia melanom Merkel -cellekarcinom og livmoderhalskræft [se ADVARSELS AND FORHOLDSREGLER ].
- Anafylaktiske reaktioner inklusive anafylaktisk stød Laryngeal/pharyngeal ødem og svær bronchospasme og anfald er blevet forbundet med infliximab -administration.
- Forbigående visuelt tab er rapporteret i forbindelse med infliximab under eller inden for 2 timer efter infusion. Cerebrovaskulære ulykker Myokardisk iskæmi/infarkt (nogle dødelige) og arytmi, der forekommer inden for 24 timer efter påbegyndelse af infusion, er også rapporteret [se ADVARSELS AND FORHOLDSREGLER ].
Eftermarkedsføring af alvorlige bivirkninger hos pædiatriske patienter
Følgende alvorlige bivirkninger er rapporteret i oplevelsen efter markedsføring hos pædiatriske patienter: infektioner (nogle dødelige) inklusive opportunistiske infektioner og tuberkulose-infusionsreaktioner overfølsomhedsreaktioner Maligniteter inklusive hepatospleniske T-celle-lymfomer [se Bokset advarsel og ADVARSELS AND FORHOLDSREGLER ] Forbigående leverenzym abnormiteter lupus-lignende syndromer og udvikling af autoantistoffer.
Lægemiddelinteraktioner for Remicannoncee
Andre biologiske produkter
Kombinationen af infliximab med andre biologiske produkter, der bruges til at behandle de samme betingelser som infliximab, anbefales ikke [se ADVARSELS AND FORHOLDSREGLER ].
En øget risiko for alvorlige infektioner blev set i kliniske studier af andre TNF -blokkeere anvendt i kombination med Anakinra eller abatacept uden tilsat klinisk fordel. På grund af arten af de bivirkninger, der ses med disse kombinationer med TNF -blokeringsterapi, kan lignende toksiciteter også være resultatet af kombinationen af Anakinra eller Abatacept med andre TNF -blokkere. Derfor anbefales kombinationen af infliximab og anakinra eller abatacept ikke [se ADVARSELS AND FORHOLDSREGLER ].
Den samtidige anvendelse af tocilizumab med biologiske dmards, såsom TNF -antagonister, herunder infliximab, bør undgås på grund af muligheden for øget immunsuppression og øget risiko for infektion.
Methotrexat og andre samtidige medicin
Specifikke lægemiddelinteraktionsundersøgelser inklusive interaktioner med methotrexat (MTX) er ikke blevet udført. Størstedelen af patienter i RA- eller CD -kliniske undersøgelser modtog en eller flere samtidige medicin. I RA var samtidige medicin udover MTX ikke-steroide antiinflammatoriske midler (NSAID'er) folinsyre Kortikosteroider og/eller narkotika. Samtidig CD-medicin var antibiotika antivirale kortikosteroider 6-MP/AZA og aminosalicylater. I PSA -kliniske forsøg inkluderede samtidig medicin MTX hos cirka halvdelen af patienterne såvel som NSAIDS -folinsyre og kortikosteroider. Samtidig MTX-anvendelse kan reducere forekomsten af anti-infliximab-antistofproduktion og øge infliximab-koncentrationer.
Immunsuppressiva
Patienter med CD, der modtog immunsuppressiva, havde en tendens til at opleve færre infusionsreaktioner sammenlignet med patienter på ingen immunsuppressiva [se Bivirkninger ]. Serum infliximab concentrations appeared to be unaffected by baseline use of medications for the treatment of CD including corticosteroids antibiotikums (metronidazole or ciprofloxacin) og aminosalicylates.
Cytochrome P450 -underlag
Dannelsen af CYP450-enzymer kan undertrykkes med forøgede niveauer af cytokiner (f.eks. TNFa IL-1 IL-6 IL-10 IFN) under kronisk inflammation. Derfor forventes det, at for et molekyle, der antagoniserer cytokinaktivitet, såsom infliximab, kunne dannelsen af CYP450 -enzymer normaliseres. Efter initiering eller seponering af infliximab hos patienter, der behandles med CYP450 -substrater med en smal terapeutisk indeksovervågning af effekten (f.eks. Warfarin) eller lægemiddelkoncentration (f.eks. Cyclosporin eller Theophylline) anbefales, og den individuelle dosis af lægemiddelproduktet kan justeres efter behov.
Levende vacciner/terapeutiske infektionsmidler
Det anbefales, at levende vacciner ikke gives samtidigt med infliximab. Det anbefales også, at levende vacciner ikke gives til spædbørn efter i utero -eksponering for infliximab i mindst 6 måneder efter fødslen [se ADVARSELS AND FORHOLDSREGLER ].
Det anbefales, at terapeutiske infektionsmidler ikke gives samtidigt med infliximab [se ADVARSELS AND FORHOLDSREGLER ].
Advarsler om Remicade
Inkluderet som en del af FORHOLDSREGLER afsnit.
Forholdsregler for Remicade
Alvorlige infektioner
Patienter, der behandles med infliximab, har en øget risiko for at udvikle alvorlige infektioner, der involverer forskellige organsystemer og steder, der kan føre til indlæggelse eller død.
Opportunistiske infektioner på grund af bakterielle mycobakterielle invasive svampevirale eller parasitiske organismer, herunder aspergillosis -blastomycosis candidiasis coccidioidomycosis cryptococcosis histoplasmosis legionellosis listeriosis pneumocystosis lalmonellosis og tuberculosis er rapporteret med TNF -blokere. Patienter har ofte præsenteret for formidlet snarere end lokal sygdom.
Behandling med infliximab bør ikke initieres hos patienter med en aktiv infektion inklusive klinisk vigtige lokaliserede infektioner. Patienter over 65 år med patienter med co-morbide tilstande og/eller patienter, der tager samtidig immunsuppressiva, såsom kortikosteroider eller methotrexat, kan have større risiko for infektion. Risikoen og fordelene ved behandling bør overvejes inden behandling af terapi hos patienter:
- med kronisk eller tilbagevendende infektion;
- der er blevet udsat for tuberkulose;
- med en historie med en opportunistisk infektion;
- der har boet eller rejst i områder af endemisk tuberkulose or endemisk mycoses such as histoplasmosis coccidioidomycosis or blastomycosis; or
- Med underliggende forhold, der kan disponere dem for infektion.
Tuberkulose
Tilfælde af reaktivering af tuberkulose eller nye tuberkuloseinfektioner er blevet observeret hos patienter, der får infliximab, inklusive patienter, der tidligere har modtaget behandling for latent eller aktiv tuberkulose. Tilfælde af aktiv tuberkulose har også forekommet hos patienter, der behandles med infliximab under behandling af latent tuberkulose.
Patienter skal evalueres for tuberkulose -risikofaktorer og testes for latent infektion inden infliximab og med jævne mellemrum på terapi. Behandling af latent tuberkuloseinfektion før terapi med TNF -blokkeere har vist sig at reducere risikoen for tuberkulose -reaktivering under terapi. Induration af 5 mM eller mere med tuberculinhud-test bør betragtes som et positivt testresultat, når man vurderer, om behandling af latent tuberkulose er nødvendig, inden det initierer infliximab, selv for patienter, der tidligere var vaccineret med Bacille Calette-Guã © RIN (BCG).
Anti-tuberkuloserapi bør også overvejes inden påbegyndelse af infliximab hos patienter med en tidligere historie med latent eller aktiv tuberkulose, i hvilken en tilstrækkelig behandling kan ikke bekræftes, og for patienter med en negativ test for latent tuberkulose, men har risikofaktorer for tuberkuloseinfektion. Konsultation med en læge med ekspertise i behandlingen af tuberkulose anbefales for at hjælpe i beslutningen om, hvorvidt påbegyndelse af anti-tuberkulosebehandling er passende for en individuel patient.
Tuberkulose should be strongly considered in patients who develop a new infection during Infliximab treatment especially in patients who have previously or recently traveled to countries with a high prevalence of tuberkulose or who have hannonce close contact with a person with active tuberkulose.
Overvågning
Patienter skal overvåges nøje for udviklingen af tegn og symptomer på infektion under og efter behandling med infliximab inklusive udviklingen af tuberkulose hos patienter, der testede negativt for latent tuberkuloseinfektion inden initiering af terapi. Tests for latent tuberkuloseinfektion kan også være falsk negativ, mens den er på terapi med infliximab.
Infliximab should be discontinued if a patient develops a serious infection or sepsis. A patient who develops a new infection during treatment with Infliximab should be closely monitored undergo a prompt og complete diagnostic workup appropriate for an immunocompromised patient og appropriate antimicrobial therapy should be initiated.
Invasive svampeinfektioner
For patienter, der bor eller rejser i regioner, hvor mycoser er endemisk invasiv svampeinfektion, skal man mistænke for, hvis de udvikler en alvorlig systemisk sygdom. Passende empirisk antifungal terapi bør overvejes, mens der udføres en diagnostisk oparbejdning. Antigen- og antistofprøvning til histoplasmose kan være negativ hos nogle patienter med aktiv infektion. Når det er muligt, skal beslutningen om at administrere empirisk antifungal terapi hos disse patienter træffes i samråd med en læge med ekspertise inden for diagnose og behandling af invasive svampeinfektioner og bør tage højde for både risikoen for alvorlig svampinfektion og risikoen for antifungal terapi.
Maligniteter
Maligniteter some fatal have been reported among children annonceolescents og young annonceults who received treatment with TNF blockers (initiation of therapy ≤18 years of age) including Infliximab. Approximately half of these cases were Lymfoms including Hodgkin’s og non-Hodgkin’s Lymfom. The other cases represented a variety of malignancies including rare malignancies that are usually associated with immunosuppression og malignancies that are not usually observed in children og annonceolescents. The malignancies occurred after a median of 30 months (range 1 to 84 months) after the first dose of TNF blocker terapi. Most of the patients were receiving concomitant immunosuppressants. These cases were reported post-marketing og are derived from a variety of sources including registries og spontaneous postmarketing reports.
Lymfomer
I de kontrollerede dele af kliniske forsøg med alle TNF -blokkeere er der observeret flere tilfælde af lymfom blandt patienter, der fik en TNF -blokkering sammenlignet med kontrolpatienter. I de kontrollerede og åbne label-dele af infliximab-kliniske forsøg udviklede 5 patienter lymfomer blandt 5707 patienter behandlet med infliximab (median varighed af opfølgning 1,0 år) vs. 0 lymfomer hos 1600 kontrolpatienter (median varighed af opfølgning 0,4 år). Hos RA blev patienter 2 lymfomer observeret for en hastighed på 0,08 tilfælde pr. 100 patientår af opfølgning, hvilket er cirka tredobbelt højere end forventet i den generelle befolkning. I den kombinerede kliniske forsøgspopulation for RA CD PSA som UC og PS 5 lymfomer blev observeret for en hastighed på 0,10 tilfælde pr. 100 patientår af opfølgning, hvilket er ca. fire gange højere end forventet i den generelle befolkning. Patienter med CD RA eller PS, især patienter med meget aktiv sygdom og/eller kronisk eksponering for immunsuppressive terapier, kan have en højere risiko (op til flere fold) end den generelle population for udviklingen af lymfom, selv i fravær af TNF -blokkeere. Tilfælde af akut og kronisk leukæmi er rapporteret med Postmarketing TNF -blokeringsanvendelse i RA og andre sygdomme. Selv i fravær af TNF-blokeringsterapipatienter med RA kan have en højere risiko (ca. 2 gange) end den generelle befolkning for udvikling af leukæmi.
Hepatosplenic T-celle lymfom (HSTCL)
Postmarkedstilfælde af hepatosplenisk T-celle-lymfom (HSTCL) En sjælden type T-celle-lymfom er rapporteret hos patienter behandlet med TNF-blokkeere inklusive infliximab. Disse tilfælde har haft et meget aggressivt sygdomsforløb og har været dødelig. Næsten alle patienter havde modtaget behandling med immunsuppressiverne azathioprin eller 6âmercaptopurin samtidig med en TNF -blokkering ved eller før diagnosen. Størstedelen af de rapporterede infliximab -tilfælde har fundet sted hos patienter med CD eller UC, og de fleste var hos unge og unge voksne mænd. Det er usikkert, om forekomsten af HSTCL er relateret til TNF -blokkeere eller TNF -blokkeere i kombination med disse andre immunsuppressiva. Når man behandler patienter, der overvejer, hvorvidt de skal bruge infliximab alene eller i kombination med andre immunsuppressiva, såsom azathioprin eller 6-mercaptopurin, skal tage hensyn til en mulighed for, at der er en højere risiko for HSTCL med kombinationsterapi versus en observeret øget risiko for immunogenicitet og hypersensivitetsreaktioner med infliximab monoterapi fra de kliniske forsøgsdata [se se ADVARSELS AND FORHOLDSREGLER og Bivirkninger ].
Hudkræft
Melanom og Merkel -cellekarcinom er rapporteret hos patienter behandlet med TNF -blokeringsterapi inklusive infliximab [se Bivirkninger ]. Periodic skin examination is recommended for all patients particularly those with risk factors for skin cancer.
Cervikal kræft
En populationsbaseret retrospektiv kohortundersøgelse ved hjælp af data fra svenske nationale sundhedsregistre fandt en stigning på 2 til 3 gange i forekomsten af invasiv livmoderhalskræft hos kvinder med RA behandlet med infliximab sammenlignet med biologiske-naã¯ve-patienter eller den generelle befolkning, især dem over 60 år. En årsagssammenhæng mellem infliximab og livmoderhalskræft kan ikke udelukkes. Periodisk screening skal fortsætte hos kvinder, der er behandlet med infliximab [se Bivirkninger ].
Andre maligniteter
I de kontrollerede dele af kliniske forsøg med nogle TNF -blokkeere, herunder infliximab -flere maligniteter (ekskl. Lymfom og ikke -melanom hudkræft [NMSC]), er blevet observeret hos patienter, der modtager disse TNF -blokkere sammenlignet med kontrolpatienter. Under de kontrollerede dele af infliximab-forsøg hos patienter med moderat til alvorligt aktiv RA CD PSA, da UC- og PS-14-patienter blev diagnosticeret med maligne lidelser (ekskl. Lymfom og NMSC) blandt 4019 infliximab-behandlede patienter vs. 1 blandt 1597 kontrolpatienter (med en hastighed på 0,52/100 patient-years blandt infliximab-behandlede patienter vs. en sats 0,11/100 patient-YEars til en patient-YEars til kontrol af infliximab-behandlede patienter Vs vs. en sats på 0,11/100 patient-YEars til en patient-YEars) til kontrol af infliximab-behandlingen Vs vs. en sats på en sats 0,11111111111111111111111111111111111111111111111111110 med median varighed af opfølgning 0,5 år for infliximab-behandlede patienter og 0,4 år for kontrolpatienter. Af disse var de mest almindelige maligniteter bryst kolorektale og melanom. Hastigheden af maligniteter blandt infliximab-behandlede patienter svarede til den forventede i den generelle population, hvorimod hastigheden hos kontrolpatienter var lavere end forventet.
I et klinisk forsøg, der undersøger brugen af infliximab hos patienter med moderat til svær kronisk obstruktiv lungesygdom (KOL) blev flere maligne lidelser rapporteret, at størstedelen af lunge- eller hoved- og halsoprindelse blev rapporteret hos infliximab-behandlede patienter sammenlignet med kontrolpatienter. Alle patienter havde en historie med tung rygning [se Bivirkninger ]. Prescribers should exercise caution when considering the use of Infliximab in patients with moderate to severe COPD.
PS -patienter skal overvåges for ikke -melanom hudkræftformer (NMSC'er), især de patienter, der har haft tidligere langvarig fototerapibehandling. I vedligeholdelsesdelen af kliniske forsøg for infliximab var NMSC'er mere almindelige hos patienter med tidligere fototerapi [se Bivirkninger ].
TNF -blokkeers potentielle rolle i udviklingen af maligniteter er ikke kendt [se Bivirkninger ]. Rates in clinical trials for Infliximab cannot be compared to rates in clinical trials of other TNF blockers og may not predict rates observed in a broannonceer patient population. Caution should be exercised in considering Infliximab treatment in patients with a history of malignancy or in continuing treatment in patients who develop malignancy while receiving Infliximab.
Hepatitis B -virusreaktivering
Brug af TNF -blokkeere inklusive infliximab er blevet forbundet med reaktivering af hepatitis B -virus (HBV) hos patienter, der er kroniske bærere af denne virus. I nogle tilfælde har HBV -reaktivering, der forekommer i forbindelse med TNF -blokeringsterapi, været dødelig. Størstedelen af disse rapporter har fundet sted hos patienter, der samtidig modtager andre medicin, der undertrykker immunsystemet, som også kan bidrage til HBV -reaktivering. Patienter skal testes for HBV -infektion, før de initierer TNF -blokeringsterapi inklusive infliximab. For patienter, der tester positivt for hepatitis B overfladeantigenkonsultation med en læge med ekspertise i behandlingen af hepatitis B, anbefales. Tilstrækkelige data er ikke tilgængelige om sikkerheden eller effektiviteten af behandling af patienter, der er bærere af HBV med anti-viral terapi i forbindelse med TNF-blokeringsterapi for at forhindre HBV-reaktivering. Patienter, der er bærere af HBV og kræver behandling med TNF -blokkeere, skal overvåges nøje for kliniske og laboratorie tegn på aktiv HBV -infektion gennem terapi og i flere måneder efter afslutning af terapi. Hos patienter, der udvikler HBV -reaktivering, skal TNF -blokkeere stoppes og Antiviral Terapi med passende understøttende behandling bør initieres. Sikkerheden ved genoptagelse af TNF -blokeringsterapi efter HBV -reaktivering er ikke kendt. Derfor bør ordinerende udvise forsigtighed, når de overvejer genoptagelse af TNF -blokeringsterapi i denne situation og overvåger patienter nøje.
Hepatotoksicitet
Der er rapporteret om alvorlige leverreaktioner, herunder akut leversvigt på gulsothepatitis og kolestase i postmarketingdata hos patienter, der modtager infliximab. Autoimmun hepatitis er blevet diagnosticeret i nogle af disse tilfælde. Alvorlige leverreaktioner forekom mellem 2 uger på mere end 1 år efter påbegyndelse af infliximab; Forhøjelser i leveraminotransferase -niveauer blev ikke bemærket før opdagelsen af leverskaden i mange af disse tilfælde. Nogle af disse tilfælde var dødelige eller nødvendige levertransplantation. Patienter med symptomer eller tegn på leverdysfunktion bør evalueres for bevis for leverskade. Hvis gulsot og/eller markerede leverenzymhøjder (f.eks. ≥5 gange den øvre grænse for normal) udvikler infliximab, bør afbrydes, og en grundig undersøgelse af abnormaliteten bør gennemføres. I kliniske forsøg er milde eller moderate højder af alt og AST blevet observeret hos patienter, der får infliximab uden progression til svær leverskade [se Bivirkninger ].
Hjertesvigt
Anvendelsen af infliximab ved doser> 5 mg/kg er kontraindiceret hos patienter med moderat eller alvorlig hjertesvigt. En randomiseret dobbeltblind placebokontrolleret undersøgelse evaluerede brugen af infliximab (5 mg/kg eller 10 mg/kg ved uge 0 2 og 6) hos patienter med moderat eller alvorlig hjertesvigt [New York Heart Association (NYHA) funktionel klasse III/IV]. Sammenlignet med patienter, der modtog placebo, var der en højere dødelighed og en højere risiko for hospitalisering i uge 28 på grund af hjertesvigt hos patienter, der modtog 10 mg/kg infliximab -dosis og højere hastigheder af hjerte -kar -bivirkninger hos patienter, der modtog infliximab -doser på 5 mg/kg og 10 mg/kg.
Amox/Clav 875
Der har været efter markedsføringsrapporter om ny begyndelse og forværring af hjertesvigt med og uden identificerbare udfældningsfaktorer (f.eks. Forudgående kardiovaskulær sygdom) hos infliximab-behandlede patienter. Nogle af disse patienter har været under 50 år.
Hvis der træffes en beslutning om at administrere infliximab (≤ 5 mg/kg) til patienter med moderat eller alvorlig hjertesvigt eller til at administrere infliximab (enhver godkendt dosis) til patienter med mild hjertesvigt, skal de overvåges nøje under terapi og infliximab skal afbrydes, hvis nye eller forværrede symptomer på hjertesvigt vises [se Kontraindikationer og Bivirkninger ].
Hæmatologiske reaktioner
Tilfælde af leukopeni -neutropeni -thrombocytopeni og pancytopenia Nogle med et dødeligt resultat er rapporteret hos patienter, der får infliximab. Årsagsforholdet til infliximab -terapi forbliver uklart. Selvom der ikke er identificeret nogen højrisikogruppe (er), bør der udvises forsigtighed hos patienter, der behandles med infliximab, der har løbende eller en historie med betydelige hæmatologiske abnormiteter. Alle patienter skal rådes til at søge øjeblikkelig lægehjælp, hvis de udvikler tegn og symptomer, der tyder på bloddycrasias eller infektion (f.eks. Vedvarende feber), mens de er på infliximab. Afbrydelse af infliximab -terapi bør overvejes hos patienter, der udvikler betydelige hæmatologiske abnormiteter.
Overfølsomhed
Infliximab has been associated with hypersensitivity reactions that vary in their time of onset og required hospitalization in some cases. Most hypersensitivity reactions (including anaphylaxis urticaria dyspnea og/or Hypotension) have occurred during or within 2 hours of Infliximab infusion.
I nogle tilfælde er serumsyge-lignende reaktioner imidlertid observeret hos patienter efter initial infliximab-terapi (dvs. så tidligt som efter den anden dosis), og når infliximab-terapi blev genindført efter en længere periode uden infliximab-behandling. Symptomer, der er forbundet med disse reaktioner, inkluderer feverudslæt hovedpine ondt i halsen Myalgier polyarthralgias hånd og ansigtsødem og/eller dysfagi. Disse reaktioner var forbundet med en markant stigning i antistoffer mod infliximab -tab af detekterbare serumkoncentrationer af infliximab og muligt tab af lægemiddeleffektivitet.
Infliximab should be discontinued for severe hypersensitivity reactions. Medications for the treatment of hypersensitivity reactions (e.g. acetaminophen antihistamines corticosteroids og/or epinephrine) should be available for immediate use in the event of a reaction [see Dosering og administration og Bivirkninger ].
I RA CD- og PS-kliniske forsøg pågælder readministration af infliximab efter en periode uden behandling resulterede i en højere forekomst af infusionsreaktioner i forhold til regelmæssig vedligeholdelsesbehandling [se Bivirkninger ]. In general the benefit-risk of re-annonceministration of Infliximab after a period of no-treatment especially as a re-induction regimen given at weeks 0 2 og 6 should be carefully considered. In the case where Infliximab maintenance therapy for Ps is interrupted Infliximab should be reinitiated as a single dose followed by maintenance terapi.
Kardiovaskulære og cerebrovaskulære reaktioner under og efter infusion
Alvorlige cerebrovaskulære ulykker Myokardisk iskæmi/infarkt (nogle dødelige) hypotension hypertension og arytmier er rapporteret i og inden for 24 timer efter påbegyndelse af infliximab -infusion. Tilfælde af kortvarigt visuelt tab er rapporteret i eller inden for 2 timer efter infusion af infliximab. Overvåg patienter under infusion, og hvis der forekommer alvorlig reaktion, ophører infusion. Yderligere håndtering af reaktioner skal dikteres af tegn og symptomer [se Bivirkninger ].
Neurologiske reaktioner
Infliximab og other agents that inhibit TNF have been associated with CNS manifestation of systemic Vasculitis seizure og new onset or exacerbation of clinical symptoms og/or rannonceiographic evidence of central nervous system demyelinating disorders including Multipel sklerose og optic neuritis og peripheral demyelinating disorders including Guillain-Barré syndrome. Prescribers should exercise caution in considering the use of Infliximab in patients with these neurologic disorders og should consider discontinuation of Infliximab if these disorders develop.
Samtidig administration med andre biologiske produkter
Alvorlige infektioner og neutropeni blev set i kliniske studier med samtidig anvendelse af Anakinra og en anden TNF -blokkering etanercept uden tilsat klinisk fordel sammenlignet med etanercept alene. På grund af arten af de bivirkninger, der ses med den samtidige anvendelse af etanercept- og Anakinra -terapi, kan lignende toksiciteter også skyldes den samtidige anvendelse af Anakinra og andre TNF -blokkeere. Derfor anbefales den samtidige anvendelse af infliximab og anakinra ikke.
I kliniske undersøgelser har samtidig administration af TNF -blokkeere og abatacept været forbundet med en øget risiko for infektioner, herunder alvorlige infektioner sammenlignet med TNF -blokkeere alene uden øget klinisk fordel. Derfor anbefales den samtidige brug af infliximab og abatacept ikke [se Lægemiddelinteraktioner ].
Der er utilstrækkelig information om den samtidige anvendelse af infliximab med andre biologiske produkter, der bruges til at behandle de samme betingelser som infliximab. Den samtidige anvendelse af infliximab med disse biologiske produkter anbefales ikke på grund af muligheden for en øget risiko for infektion [se Lægemiddelinteraktioner ].
Skift mellem biologisk sygdomsmodificerende antirheumatiske lægemidler (DMARDS)
Der skal udvises omhu, når man skifter fra en biologisk til en anden, da overlappende biologisk aktivitet yderligere kan øge risikoen for infektion.
Autoimmunity
Behandling med infliximab kan resultere i dannelse af autoantistoffer og i udviklingen af et lupuslignende syndrom. Hvis en patient udvikler symptomer, der antyder et lupuslignende syndrom efter behandling med infliximab-behandling, skal Bivirkninger ].
Vaccinationer og anvendelse af levende vacciner/terapeutiske smitsomme midler
Vaccinationer
Før de initierer infliximab hos pædiatriske og voksne patienter opdaterer vaccinationer i overensstemmelse med aktuelle vaccinationsretningslinjer.
Levende vacciner og terapeutiske infektionsmidler
Hos patienter, der modtager TNF -blokkeere, er der begrænsede data tilgængelige om responsen på vaccination med levende vacciner eller på den sekundære transmission af infektion med levende vacciner. Brug af levende vacciner kan resultere i kliniske infektioner, herunder spredte infektioner. Den samtidige administration af levende vacciner med infliximab anbefales ikke.
Dødeligt resultat på grund af formidlet BCG -infektion er rapporteret hos et spædbarn, der modtog en BCG -vaccine efter i utero -eksponering for infliximab. Infliximab er kendt for at krydse morkagen og er blevet påvist op til 6 måneder efter fødslen. Mindst en seks måneders ventetid efter fødslen anbefales inden administrationen af enhver levende vaccine til spædbørn, der er udsat i utero for at infliximab.
Andre anvendelser af terapeutiske infektionsmidler, såsom levende dæmpede bakterier (f.eks. BCG -blæreinstillation til behandling af kræft), kan resultere i kliniske infektioner, herunder spredte infektioner. Det anbefales, at terapeutiske infektionsmidler ikke gives samtidig med infliximab.
Oplysninger om patientrådgivning
Rådgive patienten eller deres plejer om at læse den FDA-godkendte patientmærkning ( Medicin vejledning ).
Patienter eller deres plejere bør rådes om de potentielle fordele og risici ved infliximab. Udbydere af sundhedsydelser bør instruere deres patienter eller deres plejere til at læse medicinguiden, før de starter infliximab -terapi og genlæser den, hver gang de får en infusion.
Infektioner
Informer patienter om, at infliximab øger risikoen for at udvikle alvorlige infektioner. Instruer patienter om vigtigheden af at kontakte deres sundhedsudbyder, hvis de udvikler symptomer på en infektion, herunder tuberkulose invasive svampeinfektioner og reaktivering af hepatitis B -virusinfektioner [se ADVARSELS AND FORHOLDSREGLER ].
Maligniteter
Maligniteter have been reported among children annonceolescents og young annonceults who received treatment with TNF blockers. Patients should be counseled about the risk of Lymfom og other malignancies while receiving Infliximab [see ADVARSELS AND FORHOLDSREGLER ].
Hepatotoksicitet
Instruer patienter om at søge lægehjælp, hvis de udvikler tegn eller symptomer på hepatotoksicitet (f.eks. Gulsot) [se ADVARSELS AND FORHOLDSREGLER ].
Hjertesvigt
Instruer patienter om at søge lægehjælp og konsultere deres recept, hvis de udvikler tegn eller symptomer på hjertesvigt [se Kontraindikationer og ADVARSELS AND FORHOLDSREGLER ].
Hæmatologiske reaktioner
Instruer patienter om at søge øjeblikkelig lægehjælp, hvis de udvikler tegn og symptomer, der tyder på bloddyscrasias eller infektion (f.eks. Vedvarende feber), mens de er på infliximab [se ADVARSELS AND FORHOLDSREGLER ].
Overfølsomhed
Rådgive patienter om øjeblikkelig lægehjælp, hvis de oplever symptomer på alvorlige overfølsomhedsreaktioner [se ADVARSELS AND FORHOLDSREGLER ].
Kardiovaskulære og cerebrovaskulære reaktioner under og efter infusion
Rådgive patienter om at søge øjeblikkelig lægehjælp, hvis de udvikler nye eller forværrede symptomer på hjerte -kar -og cerebrovaskulære reaktioner, der er rapporteret i og inden for 24 timer efter påbegyndelse af infliximab -infusion [se ADVARSELS AND FORHOLDSREGLER ].
Neurologiske reaktioner
Rådgive patienter om at søge lægehjælp, hvis de udvikler tegn eller symptomer på neurologiske reaktioner [se ADVARSELS AND FORHOLDSREGLER ].
Levende vacciner/terapeutiske infektionsmidler
Instruer infliximab-behandlede patienter for at undgå at modtage levende vacciner eller terapeutiske infektionsmidler [se ADVARSELS AND FORHOLDSREGLER ].
Ikke -klinisk toksikologi
Karcinogenese mutagenese nedskrivning af fertilitet
En 6-måneders undersøgelse i CD-1-mus blev udført for at vurdere det tumorigeniske potentiale af CV1Q anti-mus TNFa et analogt antistof. Der blev ikke observeret noget bevis for tumorigenicitet hos mus, der modtog intravenøse doser på 10 mg/kg eller 40 mg/kg CV1Q givet ugentligt. Relevansen af denne undersøgelse for menneskelig risiko er ukendt. Der blev ikke observeret nogen forringelse af fertilitets- eller reproduktive præstationsindeks i han- eller hunmus, der modtog CV1Q et analogt musesantistof ved intravenøse doser op til 40 mg/kg givet ugentligt.
Brug i specifikke populationer
Graviditet
Risikooversigt
Tilgængelige observationsundersøgelser hos gravide kvinder, der blev udsat for infliximab, viste ingen øget risiko for større misdannelser blandt levende fødsler sammenlignet med dem, der blev udsat for ikke-biologik. Resultaterne om andre fødsel og moderlige resultater var imidlertid ikke konsistente på tværs af undersøgelser af forskellige undersøgelsesdesign og adfærd (se Data ).
Monoklonale antistoffer såsom infliximab overføres over morkagen i løbet af tredje trimester af graviditeten og kan påvirke immunresponsen i det i utero -udsatte spædbarn (se Kliniske overvejelser ). Because infliximab does not cross-react with TNFα in species other than humans og chimpanzees animal reproduction studies have not been conducted with Infliximab. In a developmental study conducted in mice using an analogous antibody no evidence of maternal toxicity or fetal harm was observed (see Data ).
Alle graviditeter har en baggrundsrisiko for fødselsdefekt tab eller andre ugunstige resultater.
Den estimerede baggrundsrisiko for store fødselsdefekter og spontanabort for de angivne populationer er ukendt. I den amerikanske generelle befolkning er den estimerede baggrundsrisici for vigtige fødselsdefekter og spontanabort i klinisk anerkendte graviditeter henholdsvis 2-4% og 15-20%.
Kliniske overvejelser
Sygdomsassocieret moderlig og/eller embryo/føtal risiko
Publicerede data antyder, at der er en øget risiko for ugunstige graviditetsresultater hos kvinder med inflammatorisk tarmsygdom eller reumatoid arthritis forbundet med øget sygdomsaktivitet. Bivirkning af graviditet inkluderer for tidlig levering (før 37 ugers drægtighed) lav fødselsvægt (mindre end 2,5 kg) og lille for svangerskabsalder ved fødslen.
Føtal/neonatal bivirkninger
Som med andre IgG -antistoffer krydser infliximab placenta. Infliximab er blevet påvist i serum af spædbørn op til 6 måneder efter fødslen. Derfor kan disse spædbørn have en øget risiko for infektion, herunder formidlet infektion, som kan blive dødelig. Mindst en seks måneders ventetid efter fødslen anbefales før administrationen af levende vacciner (f.eks. BCG -vaccine eller andre levende vacciner, såsom rotavirusvaccinen) til disse spædbørn [se ADVARSELS AND FORHOLDSREGLER ]. Cases of Agranulococytisis in infants exposed in utero have also been reported [see Bivirkninger ].
Data
Menneskelige data
To prospektive kohortundersøgelser blev udført vurdering af fødselsresultater såvel som spædbørns sundhedsstatus op til et år hos kvinder, der blev udsat for infliximab sammenlignet med ikke-biologiske komparatorer, herunder methotrexat azathioprin 6-mercaptopurin og systemiske kortikosteroider, der blev anvendt til behandling af lignende ydelser. Den første undersøgelse blev udført i et IBD-graviditetsregister i USA og vurderede graviditetsresultater hos 294 kvinder med inflammatorisk tarmsygdom udsat for infliximab under graviditet sammenlignet med 515 kvinder på en ikke-biologisk behandling. Infliximab -eksponering var ikke forbundet med øgede frekvenser af større medfødte misdannelsesbesætninger/dødfødselsbørn med lav fødselsvægt lille for svangerskabsalder eller infektion i det første leveår. Den anden undersøgelse blandt IBD- og ikke-IBD-patienter i Sverige Finland og Danmark sammenlignede 97 7 og 166 kvinder udsat for infliximab til henholdsvis 2693 2499 og 1268 kvinder på ikke-biologisk systemisk terapi. I denne undersøgelse blev sammenligning af samlede data på tværs af de tre lande, der eksponerede for infliximab, ikke forbundet med øgede frekvenser af medfødte afvigelser eller spædbarnsdød. Infliximab i kombination med immunsuppressiva (hovedsageligt systemiske kortikosteroider og azathioprin) var forbundet med øgede frekvenser af for tidlig fødsel lille for svangerskabsalder Lav fødselsvægt og spædbørnshospitalisering til infektion sammenlignet med ikke-biologisk systemisk behandling. Selvom undersøgelsen ikke viste nogen tilknytning til infliximab monoterapi, kunne analyserne have været underpowered for at detektere en forening.
Der var yderligere metodologiske begrænsninger med disse undersøgelser, der kan tage højde for undersøgelsesresultaterne i begge undersøgelser: den samtidige anvendelse af andre medicin eller behandlinger blev ikke kontrolleret, og sygdomsgraden blev ikke vurderet; I den amerikanske undersøgelse blev patienten rapporterede, at resultaterne blev indsamlet uden klinisk validering. Disse metodologiske begrænsninger hindrer fortolkningen af undersøgelsesresultaterne.
Dyredata
Fordi infliximab-produkter ikke krydsreakt med TNFa hos andre arter end mennesker og chimpanser, er dyreproduktionsundersøgelser ikke blevet udført med infliximab. En embryofetaludviklingsundersøgelse blev udført hos gravide mus under anvendelse af CV1Q anti-mus TNFa et analogt antistof, der selektivt hæmmer den funktionelle aktivitet af mus TNFa. Dette antistof, der blev administreret hos mus i perioden med organogenese på drægtighedsdage (GDS) 6 og 12 ved IV -doser op til 40 mg/kg, frembragte intet bevis for moderlig toksicitetsføtal dødelighed eller strukturelle abnormiteter. Doser på 10 til 15 mg/kg i farmakodynamiske dyremodeller med anti-TNF analogt antistof producerede maksimal farmakologisk effektivitet. Analyser af fosterprøver på GD 14 indikerede placentaloverførsel af antistoffet og eksponeringen af fostre under organogenese. I en peri-og-fødsel-udviklingsundersøgelse hos mus blev der ikke observeret nogen moderlig toksicitet eller ugunstige udviklingseffekter hos afkom, når dæmninger blev administreret IV-doser på 10 eller 40 mg/kg af det analoge antistof på GDS 6 12 og 18 og laktationsdage 3 9 og 15.
Amning
Risikooversigt
Offentliggjort litteratur viser, at infliximab er til stede på lave niveauer i human mælk. Systemisk eksponering hos et ammet spædbarn forventes at være lav, fordi infliximab stort set nedbrydes i mave -tarmkanalen. En amerikansk multicenterundersøgelse af 168 kvinder behandlet med infliximab for inflammatorisk tarmsygdom (modermælkprøver opnået n = 29) viste, at spædbørn, der blev udsat for infliximab gennem modermælk, ikke havde nogen stigning i infektioner og udviklet normalt. Der er ingen data om virkningerne af infliximab på mælkeproduktionen. De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med mors kliniske behov for infliximab og eventuelle bivirkninger på det ammede barn fra infliximab eller fra den underliggende moderlige tilstand.
Pædiatrisk brug
Sikkerheden og effektiviteten af infliximab er etableret hos pædiatriske patienter 6 til 17 år til induktion og vedligeholdelsesbehandling af CD og UC [se Dosering og administration og Bivirkninger ]. However the safety og effectiveness of Infliximab in pediatric patients <6 years of age with CD or UC have not been established. The safety og effectiveness of Infliximab in the treatment of pediatric patients with Ps og juvenile reumatoid arthritis (JRA) have not been established.
Pædiatrisk Crohns sygdom
Sikkerheden og effektiviteten af infliximab er blevet fastlagt for at reducere tegn og symptomer og inducere og opretholde klinisk remission hos pædiatriske patienter 6 år og ældre med moderat til alvorligt aktiv CD, der har haft en utilstrækkelig respons på konventionel terapi. Brugen af infliximab til denne indikation understøttes af bevis fra en randomiseret open-label pediatrisk CD-undersøgelse hos 112 pædiatriske patienter i alderen 6 år og ældre [se Kliniske studier ].
Infliximab has been studied only in combination with conventional immunosuppressive therapy in pediatric CD. The longer term (greater than 1 year) safety og effectiveness of Infliximab in pediatric CD patients have not been established in clinical trials.
Postmarkedstilfælde af HSTCL er rapporteret hos pædiatriske patienter behandlet med TNF -blokkeere inklusive infliximab. På grund af risikoen for HSTCL bør der foretages en omhyggelig risiko-fordel-vurdering, når infliximab bruges i kombination med andre immunsuppressiva hos pædiatriske CD-patienter [se Bokset advarsel ADVARSELS AND FORHOLDSREGLER ].
Pædiatrisk ulcerøs colitis
Sikkerheden og effektiviteten af infliximab til reduktion af tegn og symptomer og induktion og opretholdelse af klinisk remission hos pædiatriske patienter i alderen 6 år og ældre med moderat til alvorligt aktiv UC, der har haft en utilstrækkelig respons på konventionel terapi, er blevet fastlagt. Brugen af infliximab til denne indikation understøttes af bevis fra tilstrækkelige og godt kontrollerede undersøgelser af infliximab hos voksne med yderligere sikkerhed og farmakokinetiske data fra en open-label pædiatrisk UC-undersøgelse hos 60 pædiatriske patienter i alderen 6 år og ældre [se Dosering og administration Bivirkninger og Kliniske studier ]. The effectiveness of Infliximab in inducing og maintaining mucosal healing in pediatric UC was not established. Although 41 patients hannonce a Mayo endoscopy subscore of 0 or 1 at the Uge 8 endoscopy the induction phase was open-label og lacked a control group. Only 9 patients hannonce an optional endoscopy at Uge 54. Approximately half of the patients were on concomitant immunomodulators (AZA 6-MP MTX) at study start.
På grund af risikoen for HSTCL bør der foretages en omhyggelig risiko-fordel-vurdering, når infliximab bruges i kombination med andre immunsuppressiva hos pædiatriske UC-patienter [se Bokset advarsel og ADVARSELS AND FORHOLDSREGLER ].
Den længere sigt (større end 1 år) sikkerhed og effektivitet af infliximab hos pædiatriske UC -patienter er ikke blevet fastlagt i kliniske forsøg.
Juvenil Rheumatoid Arthritis (JRA)
Sikkerheden og effektiviteten af infliximab til behandling af pædiatriske patienter med juvenil reumatoid arthritis (JRA) er ikke blevet etableret.
Sikkerheden og effektiviteten af infliximab hos patienter med JRA blev evalueret i en multicenter randomiseret placebokontrolleret dobbeltblind undersøgelse i 14 uger efterfulgt af en dobbeltblind all-aktiv behandlingsforlængelse i højst 44 uger. Patienter med aktiv JRA i alderen 4 og 17 år, der var blevet behandlet med MTX i mindst 3 måneder, blev tilmeldt. Samtidig anvendelse af folinsyre orale kortikosteroider (≤0,2 mg/kg/dag prednison eller ækvivalente) NSAID'er og/eller sygdom, der modificerer antirheumatiske lægemidler (DMARD'er), var tilladt.
Doser på 3 mg/kg infliximab eller placebo blev administreret intravenøst i uger 0 2 og 6. Patienter, der blev randomiseret til placebo-krydsede over for at modtage 6 mg/kg infliximab i uger 14 16 og 20 og derefter hver 8. uge til uge 44. Patienter, der afsluttede undersøgelsen, fortsatte med at modtage åbent mærket behandling med infliximab i op til 2 år i en ledsagende udvidelsesundersøgelse.
Undersøgelsen kunne ikke fastlægge effektiviteten af infliximab i behandlingen af JRA. De vigtigste observationer i undersøgelsen omfattede en høj placebo -responsrate og en højere immunogenicitetshastighed end hvad der er observeret hos voksne. Derudover blev der observeret en højere clearance af infliximab, end det var blevet observeret hos voksne.
Population pharmacokinetic analysis showed that in pediatric patients with JRA with a body weight of up to 35 kg receiving 6 mg/kg Infliximab and pediatric patients with JRA with body weight greater than 35 kg up to adult body weight receiving 3 mg/kg Infliximab the steady state area under the concentration curve (AUCss) was similar to that observed in adults receiving 3 mg/kg of Infliximab.
I alt 60 patienter med JRA blev behandlet med doser på 3 mg/kg, og 57 patienter blev behandlet med doser på 6 mg/kg. Andelen af patienter med infusionsreaktioner, der modtog 3 mg/kg infliximab, var 35% (21/60) over 52 uger sammenlignet med 18% (10/57) hos patienter, der modtog 6 mg/kg over 38 uger. De rapporterede mest almindelige infusionsreaktioner var opkastende feberhovedpine og hypotension. I 3 mg/kg infliximab -gruppen 4 havde patienter en alvorlig infusionsreaktion, og 3 patienter rapporterede om en mulig anafylaktisk reaktion (hvoraf 2 var blandt de alvorlige infusionsreaktioner). I de 6 mg/kg infliximab -gruppe 2 havde patienter en alvorlig infusionsreaktion, hvoraf 1 havde en mulig anafylaktisk reaktion. To af de 6 patienter, der oplevede alvorlige infusionsreaktioner, modtog infliximab ved hurtig infusion (varighed på mindre end 2 timer). Antistoffer mod infliximab udviklede sig i 38% (20/53) af patienter, der modtog 3 mg/kg infliximab sammenlignet med 12% (6/49) af patienter, der modtog 6 mg/kg.
I alt 68% (41/60) af patienter, der modtog 3 mg/kg infliximab i kombination med MTX, oplevede en infektion over 52 uger sammenlignet med 65% (37/57) af patienter, der modtog 6 mg/kg infliximab i kombination med MTX over 38 uger. De mest almindeligt rapporterede infektioner var øvre luftvejsinfektion og faryngitis, og den mest almindeligt rapporterede alvorlige infektion var lungebetændelse. Andre bemærkelsesværdige infektioner inkluderede primær varicellainfektion hos 1 patient og herpes zoster hos 1 patient.
Geriatrisk brug
Af det samlede antal infliximab-behandlede patienter i RA- og PS-kliniske studier var 256 (9,6%) 65 år gamle og derover, mens 17 (0,6%) var 75 år gamle og derover. I disse forsøg blev der ikke observeret nogen samlede forskelle i sikkerhed eller effektivitet mellem geriatriske patienter (patienter ≥ 65 år) og yngre voksne patienter (patienter 18 til 65 år gamle). Forekomsten af alvorlige bivirkninger hos geriatriske patienter var imidlertid højere i både infliximab og kontrolgrupper sammenlignet med yngre voksne patienter.
Af det samlede antal infliximab-behandlede patienter i CD UC AS og PSA-kliniske undersøgelser var 76 (3,2%) 65 år gamle og derover, mens 9 (0,4%) var 75 år gamle og derover. I CD UC AS og PSA -undersøgelser var der utilstrækkeligt antal geriatriske patienter til at afgøre, om de reagerer forskelligt fra yngre voksne.
Forekomsten af alvorlige infektioner hos infliximab-behandlede geriatriske patienter var større end hos infliximab-behandlede yngre voksne patienter; Derfor anbefales tæt overvågning af geriatriske patienter til udvikling af alvorlige infektioner [se ADVARSELS AND FORHOLDSREGLER og Bivirkninger ].
Overdoseringsoplysninger til Remicade
Enkelt doser op til 20 mg/kg er blevet administreret uden nogen direkte toksisk virkning. I tilfælde af overdosering anbefales det, at patienten overvåges for tegn eller symptomer på bivirkninger eller effekter [se ADVARSELS AND FORHOLDSREGLER ] og passende symptomatisk behandling indført øjeblikkeligt.
Kontraindikationer for remicade
Brug af infliximab ved doser> 5 mg/kg er kontraindiceret hos patienter med moderat eller alvorlig hjertesvigt [se ADVARSELS AND FORHOLDSREGLER og Bivirkninger ].
Infliximab is contraindicated in patients with a previous severe hypersensitivity reaction to infliximab or any of the inactive ingredients of Infliximab or any murine proteins [severe hypersensitivity reactions have included anaphylaxis Hypotension og serum sickness] [see ADVARSELS AND FORHOLDSREGLER og Bivirkninger ].
Klinisk farmakologi for Remicannoncee
Handlingsmekanisme
Infliximab neutralizes the biological activity of TNFα by binding with high affinity to the soluble og transmembrane forms of TNFα og inhibits binding of TNFα with its receptors. Infliximab does not neutralize TNFβ (lymphotoxin-α) a related cytokine that utilizes the same receptors as TNFα. Biological activities attributed to TNFα include: induction of pro-inflammatory cytokines such as interleukins (IL) 1 og 6 enhancement of leukocyte migration by increasing endothelial layer permeability og expression of annoncehesion molecules by endothelial cells og leukocytes activation of neutrophil og eosinophil functional activity induction of acute phase reactants og other liver proteins as well as tissue degrannonceing enzymes produced by synoviocytes og/or chondrocytes. Cells expressing transmembrane TNFα bound by infliximab can be lysed in vitro or in vivo. Infliximab inhibits the functional activity of TNFα in a wide variety of in vitro bioassays utilizing human fibroblasts endothelial cells neutrophils B og T-lymphocytes og epithelial cells. The relationship of these biological response markers to the mechanism(s) by which Infliximab exerts its clinical effects is unknown. Anti-TNFα antibodies reduce disease activity in the cotton -top tamarin colitis model og decrease synovitis og joint erosions in a murine model of collagen-induced arthritis. Infliximab prevents disease in transgenic mice that develop polyarthritis as a result of constitutive expression of human TNFα og when annonceministered after disease onset allows eroded joints to heal.
Farmakodynamik
Forhøjede koncentrationer af TNFa er fundet i involverede væv og væsker fra patienter med RA CD UC som PSA og PS. Ved RA-behandling med infliximab reduceret infiltration af inflammatoriske celler i betændte områder af leddet såvel som ekspression af molekyler, der medierer cellulær adhæsion [e-selectin intercellulær adhæsionsmolekyle-1 (ICAM-1) og vaskulær celleadhæsionsmolekyle-1 (VCAM-1)] kemoattraktion [IL-8 og monocyte-kemiskprotein (MCHP-1)]] og makse og maksisker) og maksisker) og maksisken) og maksisken) og maksisk Nedbrydning [Matrix Metalloproteinase (MMP) 1 og 3]. Ved CD -behandling med infliximab reducerede infiltration af inflammatoriske celler og TNFa -produktion i betændte områder af tarmen og reducerede andelen af mononukleære celler fra lamina propria i stand til at udtrykke TNFa og interferon. Efter behandling med infliximab-patienter med RA eller CD udviste nedsatte niveauer af serum IL-6 og C-reaktivt protein (CRP) sammenlignet med baseline. Perifere blodlymfocytter fra infliximab-behandlede patienter viste intet signifikant fald i antal eller i proliferative responser på in vitro mitogen stimulering sammenlignet med celler fra ubehandlede patienter. I PSA-behandling med infliximab resulterede i en reduktion i antallet af T-celler og blodkar i synovium og psoriasisiske hudlæsioner samt en reduktion af makrofager i synoviet. I PS -infliximab -behandling kan reducere epidermal tykkelse og infiltration af inflammatoriske celler. Forholdet mellem disse farmakodynamiske aktiviteter og mekanismen (er), hvormed infliximab udøver sine kliniske virkninger, er ukendt.
Farmakokinetik
Hos voksne viste enkelt intravenøse (IV) infusioner af 3 mg/kg til 20 mg/kg (to gange den maksimale anbefalede dosis for enhver indikation) et lineært forhold mellem den indgivne dosis og den maksimale serumkoncentration. Distributionsvolumen i stabil tilstand var uafhængig af dosis og indikerede, at infliximab primært blev fordelt i det vaskulære rum. Farmakokinetiske resultater for enkeltdoser på 3 mg/kg til 10 mg/kg i RA 5 mg/kg i CD og 3 mg/kg til 5 mg/kg i PS indikerer, at medianterminalhalveringstiden for infliximab er 7,7 til 9,5 dage.
Efter en indledende dosis af infliximab gentagne infusioner efter 2 og 6 uger resulterede i forudsigelige profiler med koncentrationstid efter hver behandling. Ingen systemisk ophobning af infliximab forekom ved fortsat gentagen behandling med 3 mg/kg eller 10 mg/kg med 4-eller 8-ugers intervaller. Udvikling af antistoffer til infliximab øgede infliximab clearance. 8 uger efter en vedligeholdelsesdosis på 3 til 10 mg/kg infliximab median infliximab -serumkoncentrationer varierede fra ca. 0,5 til 6 mcg/ml; Imidlertid var infliximab -koncentrationer ikke påviselige (<0.1 mcg/mL) in patients who became positive for antibodies to infliximab. No major differences in clearance or volume of distribution were observed in patient subgroups defined by age weight or gender. It is not known if there are differences in clearance or volume of distribution in patients with marked impairment of hepatic or renal function.
Infliximab pharmacokinetic characteristics (including peak og trough concentrations og terminal half-life) were similar in pediatric (aged 6 to 17 years) og annonceult patients with CD or UC following the annonceministration of 5 mg/kg of Infliximab.
Kliniske studier
Voksen Crohns sygdom
Aktiv Crohns sygdom hos voksne
Sikkerheden og effektiviteten af enkelt- og flere doser af infliximab blev vurderet i 2 randomiserede dobbeltblind placebokontrollerede kliniske studier hos 653 voksne patienter med moderat til alvorligt aktiv CD [Crohns sygdomsaktivitetsindeks (CDAI) ≥220 og ≤400] med en utilstrækkelig respons på forudgående konventionelle terapier. Samtidig stabile doser af aminosalicylater kortikosteroider og/eller immunmodulerende midler var tilladt, og 92% af patienterne fortsatte med at modtage mindst en af disse medicin.
I enkeltdosisforsøget hos 108 voksne patienter opnåede 16% (4/25) af placebo-patienter en klinisk respons (fald i CDAI ≥70 point) i uge 4 mod 81% (22/27) af patienter, der fik 5 mg/kg infliximab (P<0.001 two-sided Fisher’s Exact test). Additionally 4% (1/25) of placebo patients og 48% (13/27) of patients receiving 5 mg/kg Infliximab achieved clinical remission (CDAI<150) at Week 4.
I et multidoseforsøg (accent I [undersøgelse Crohns I]) 545 voksne patienter modtog 5 mg/kg i uge 0 og blev derefter randomiseret til en af tre behandlingsgrupper; Placebo -vedligeholdelsesgruppen modtog placebo i uge 2 og 6 og derefter hver 8. uge; Den 5 mg/kg vedligeholdelsesgruppe modtog 5 mg/kg i uge 2 og 6 og derefter hver 8. uge; og vedligeholdelsesgruppen 10 mg/kg modtog 5 mg/kg i uge 2 og 6 og derefter 10 mg/kg hver 8. uge. Patienter som svar i uge 2 blev randomiseret og analyseret separat fra dem, der ikke var svar i uge 2.. Kortikosteroid -konisk var tilladt efter uge 6.
I uge 2 57% (311/545) af patienter var i klinisk respons. I uge 30 opnåede en signifikant større andel af disse patienter i 5 mg/kg og 10 mg/kg vedligeholdelsesgrupper klinisk remission sammenlignet med patienter i placebo -vedligeholdelsesgruppen (tabel 3).
Derudover var en signifikant større andel af patienterne i 5 mg/kg og 10 mg/kg infliximab -vedligeholdelsesgrupper i klinisk remission og var i stand til at afbryde kortikosteroidbrug sammenlignet med patienter i placebo -vedligeholdelsesgruppen i uge 54 (tabel 3).
Tabel 3: Klinisk remission og steroid tilbagetrækning hos voksne patienter med CD (undersøgelse Crohns I)
| Enkelt 5 mg/kg dosisa | Tre-dosis induktionb | ||
| Placebo Maintenance | Infliximab Maintenance Q8 WKS | ||
| 5 mg/kg | 10 mg/kg | ||
| Uge 30 | 25/102 | 41/104 | 48/105 |
| Klinisk remission | 25% | 39% | 46% |
| P-værdic | 0.022 | 0.001 | |
| Uge 54 | 6/54 | 14/56 | 18/53 |
| Patienter i remission i stand til at afbryde brug af kortikosteroidd | 11% | 25% | 34% |
| P-værdic | 0.059 | 0.005 | |
| a Infliximab at Week 0 b Infliximab 5 mg/kg annonceministered at Weeks 0 2 og 6 c P-værdis represent pairwise comparisons to placebo d Af dem, der modtager kortikosteroider ved baseline |
Patienter i infliximab -vedligeholdelsesgrupper (5 mg/kg og 10 mg/kg) havde længere tid til tab af respons end patienter i placebo -vedligeholdelsesgruppen (figur 1). I uger 30 og 54 blev der set signifikant forbedring fra baseline blandt de 5 mg/kg og 10 mg/kg infliximab-behandlede grupper sammenlignet med placebogruppen i den sygdomsspecifikke inflammatoriske tarmsygdomsspørgeskema (IBDQ), især tarm- og systemiske komponenter og i den fysiske komponents resumé af den generelle sundhedsrelaterede livskvalitet for livets spørgeskema SF-36.
Figur 1: Kaplan-Meier estimat af andelen af voksne med CD, der ikke havde mistet responsen gennem uge 54 (Study Crohns I)
 |
I en undergruppe af 78 patienter, der havde slimhinde-ulceration ved baseline, og som deltog i en endoskopisk substudy 13 af 43 patienter i infliximab-vedligeholdelsesgruppen, havde endoskopiske beviser for slimhindeheling sammenlignet med 1 af 28 patienter i placebogruppen i uge 10. af de infliximab-behandlingspatienter, der viste slimosal heling i uge 10 9 af 12 patienter også i slimhindet i ugen 54.
Patienter, der opnåede et svar og efterfølgende mistede respons, var berettigede til at modtage infliximab på episodisk grundlag i en dosis, der var 5 mg/kg højere end den dosis, som de blev randomiseret til. Størstedelen af sådanne patienter reagerede på den højere dosis. Blandt patienter, der ikke var svar i uge 2 59% (92/157) af infliximab -vedligeholdelsespatienter, svarede i uge 14 sammenlignet med 51% (39/77) af patienter med vedligeholdelsespatienter. Blandt patienter, der ikke svarede i uge 14 Yderligere terapi, resulterede ikke i signifikant flere svar [se Dosering og administration ].
Fistulisering af Crohns sygdom hos voksne
Sikkerheden og effektiviteten af infliximab blev vurderet i 2 randomiserede dobbeltblinde placebokontrollerede studier hos voksne patienter med fistulisering af CD med fistler (er), der var af mindst 3 måneders varighed. Samtidig anvendelse af stabile doser af kortikosteroider 5-aminosalicylater Antibiotika MTX 6-mercaptopurin (6-MP) og/eller azathioprin (AZA) var tilladt.
I det første forsøg modtog 94 voksne patienter 3 doser af enten placebo eller infliximab i uger 0 2 og 6. Fistelrespons (≥50% reduktion i antallet af enterokutane fistler, der blev drænet på blid komprimering på mindst 2 på hinanden følgende besøg uden en stigning i medicin eller kirurgi for CD) og 56% (21/31) af patienter i 5 MG/KG -mobiximabgruppen (p = 0,002) og 56% (18/32) af patienter i 10 mg/kg infliximab -gruppen (P = 0,021) mod 26% (8/31) af patienter i placebo -armen. Den median tid til begyndelse af respons og median varighed af respons hos infliximab-behandlede patienter var henholdsvis 2 og 12 uger. Lukning af alle fistler blev opnået hos 52% af infliximab-behandlede patienter sammenlignet med 13% af placebo-behandlede patienter (P<0.001).
I det andet forsøg (Accent II [Study Crohnâ € ™ s II]) voksede voksne patienter, der blev tilmeldt, at have mindst 1 dræning af enterokutan (perianal abdominal) fistel. Alle patienter modtog 5 mg/kg infliximab i uger 0 2 og 6. Patienter blev randomiseret til placebo eller 5 mg/kg infliximab -vedligeholdelse i uge 14. Patienter modtog vedligeholdelsesdoser i uge 14 og derefter hver 8. uge til uge 46. Patienter, der var i fistelrespons (fistelrespons, blev defineret på samme måde som i den første forsøg) i begge uger 10 og 14 blev randomiserede separat fra dem, der ikke var i respons. Det primære slutpunkt var tid fra randomisering til tab af respons blandt de patienter, der var i fistelrespons.
Blandt de randomiserede patienter (273 af de 296 oprindeligt tilmeldte) havde 87% perianale fistler og 14% havde abdominale fistler. Otte procent havde også rektovaginale fistler. Større end 90% af patienterne havde modtaget tidligere immunsuppressiv og antibiotikum terapi.
I uge var 14 65% (177/273) af patienterne i fistelrespons. Patienter, der er randomiseret til infliximab -vedligeholdelse, havde længere tid til tab af fistelrespons sammenlignet med placebo -vedligeholdelsesgruppen (figur 2). I uge 54% (33/87) af infliximab-behandlede patienter havde ingen dræningsfistler sammenlignet med 22% (20/90) af placebo-behandlede patienter (P = 0,02). Sammenlignet med patienter med vedligeholdelse af placebo havde vedligeholdelse af infliximab en tendens mod færre indlæggelser.
Figur 2: Livstabelestimater af andelen af voksne CD -patienter, der ikke havde mistet fistelrespons gennem uge 54 (Study Crohns II)
 |
Patienter, der opnåede en fistelrespons og efterfølgende mistede respons, var berettigede til at modtage infliximab -vedligeholdelsesbehandling i en dosis, der var 5 mg/kg højere end den dosis, som de blev randomiseret til. Af placebo -vedligeholdelsespatienterne svarede 66% (25/38) på 5 mg/kg infliximab og 57% (12/21) af infliximab -vedligeholdelsespatienter reagerede på 10 mg/kg.
Det var usandsynligt, at patienter, der ikke havde opnået et svar i uge 14, reagerede på yderligere doser af infliximab.
Lignende andele af patienter i begge grupper udviklede nye fistler (17% samlet) og lignende tal udviklede abscesser (15% samlet).
Pædiatrisk Crohns sygdom
Sikkerheden og effektiviteten af infliximab blev vurderet i en randomiseret open-label-undersøgelse (undersøgelse PEDS Crohns) hos 112 pædiatriske patienter i alderen 6 til 17 år med moderat til alvorligt aktiv CD og en utilstrækkelig respons på konventionelle terapier. Medianalderen var 13 år, og den median pædiatriske Crohns sygdomsaktivitetsindeks (PCDAI) var 40 (i en skala fra 0 til 100). Alle patienter skulle være på en stabil dosis på 6-MP AZA eller MTX; 35% modtog også kortikosteroider ved baseline.
Alle patienter modtog induktionsdosering på 5 mg/kg infliximab i uger 0 2 og 6. Ved uge blev 10 103 patienter randomiseret til et vedligeholdelsesregime på 5 mg/kg infliximab givet enten hver 8. uge eller hver 12. uge.
I uge var 10 88% af patienterne i klinisk respons (defineret som et fald fra baseline i PCDAI -score på ≥15 point og den samlede PCDAI -score på ≤30 point) og 59% var i klinisk remission (defineret som PCDAI -score på ≤10 point).
Andelen af pædiatriske patienter, der opnår klinisk respons i uge 10, sammenlignede positivt med andelen af voksne, der opnåede en klinisk respons i studiet Crohns I. Undersøgelsesdefinitionen af klinisk respons i undersøgelsespids Crohns I.
På både uge 30 og uge 54 var andelen af patienter i klinisk respons større i hver 8-ugers behandlingsgruppe end i hver 12-ugers behandlingsgruppe (73% mod 47% i uge 30 og 64% mod 33% i uge 54). På både uge 30 og uge 54 var andelen af patienter i klinisk remission også større i hver 8-ugers behandlingsgruppe end i hver 12-ugers behandlingsgruppe (60% mod 35% i uge 30 og 56% mod 24% i uge 54) (tabel 4).
For patienter i undersøgelse af PEDS Crohns modtagelse af kortikosteroider ved baseline var andelen af patienter, der var i stand til at afbryde kortikosteroider, mens de var i remission i uge 30, 46% for hver 8-ugers vedligeholdelsesgruppe og 33% for hver 12-ugers vedligeholdelsesgruppe. I uge 54 var andelen af patienter, der var i stand til at afbryde kortikosteroider, mens de var i remission, 46% for hver 8-ugers vedligeholdelsesgruppe og 17% for hver 12-ugers vedligeholdelsesgruppe.
Tabel 4: Respons og remission i studiet PEDS Crohns
| 5 mg/kg Infliximab | ||
| Hver 8. uge | Hver 12. uge | |
| Behandlingsgruppe | Behandlingsgruppe | |
| Patienter randomiseret | 52 | 51 |
| Klinisk responsa | ||
| Uge 30 | 73%d | 47% |
| Uge 54 | 64%d | 33% |
| Klinisk remissionb | ||
| Uge 30 | 60%c | 35% |
| Uge 54 | 56%d | 24% |
| a Defineret som et fald fra baseline i PCDAI -score på ≥15 point og den samlede score på ≤30 point. b Defineret som en PCDAI -score på ≤10 point. c P-værdi <0.05 d P-værdi <0.01 |
Voksen ulcerøs colitis
Sikkerheden og effektiviteten af infliximab blev vurderet i 2 randomiserede dobbeltblinde placebokontrollerede kliniske undersøgelser hos 728 voksne patienter med moderat til alvorligt aktiv UC (mayo score 6 til 12 [af mulig interval 0 til 12] endoskopi-undercore ≥2) med en utilstrækkelig respons på konventionelle orale terapier (undersøgelser UC I og UC II). Samtidig behandling med stabile doser af aminosalicylater kortikosteroider og/eller immunmodulerende midler var tilladt. Kortikosteroid -konisk var tilladt efter uge 8. Patienter blev randomiseret i uge 0 til at modtage enten placebo 5 mg/kg infliximab eller 10 mg/kg infliximab i uger 0 2 6 og hver 8. uge derefter gennem uge 46 i undersøgelse UC I og ved uger 0 2 6 og hver 8. uge dertil gennem uge 22 i undersøgelse UC II. I undersøgelsen af UC II fik patienter lov til at tænde den blindede terapi til uge 46 efter efterforskerens skøn.
Voksne patienter i undersøgelse UC Jeg havde undladt at reagere eller var intolerante over for orale kortikosteroider 6-MP eller AZA. Voksne patienter i undersøgelse UC II havde undladt at reagere eller var intolerante over for ovenstående behandlinger og/eller aminosalicylater. Lignende andele af patienter i undersøgelser UC I og UC II modtog kortikosteroider (henholdsvis 61% og 51%) 6-MP/AZA (49% og 43%) og aminosalicylater (70% og 75%) ved baseline. Flere patienter i undersøgelse UC II end UC I tog udelukkende aminosalicylater til UC (henholdsvis 26% mod 11%). Klinisk respons blev defineret som et fald fra baseline i mayo -score med ≥30% og ≥3 point ledsaget af et fald i den rektale blødning underkore på ≥1 eller en rektal blødning underkore på 0 eller 1.
Klinisk respons Klinisk remission And Slimhindeheling
I både undersøgelse opnåede UC I og undersøgelse UC II større procentdele af patienter i begge infliximab -grupper opnåede klinisk respons klinisk remission og slimhindeheling end i placebogruppen. Hver af disse effekter blev opretholdt gennem slutningen af hver forsøg (uge 54 i undersøgelse UC I og uge 30 i undersøgelse UC II). Derudover demonstrerede en større andel af patienter i infliximab -grupper vedvarende respons og vedvarende remission end i placebogrupper (tabel 5).
Af patienter på kortikosteroider ved baseline større proportioner af voksne patienter i infliximab -behandlingsgrupperne var i klinisk remission og kunne afbryde kortikosteroider i uge 30 sammenlignet med patienterne i placebo -behandlingsgrupper (22% i infliximab -behandlingsgrupper mod 10% i placebogruppe i undersøgelse UC I; 23% i infliximab -behandlingsgrupper mod 3% i placebo -grupper i studiet UC II). I undersøgelse UC I blev denne effekt opretholdt gennem uge 54 (21% i infliximab -behandlingsgrupper mod 9% i placebogruppe). Den infliximab-associerede respons var generelt ens i de 5 mg/kg og 10 mg/kg dosisgrupper.
Tabel 5: Respons Remission og slimhindeheling i voksne UC -undersøgelser (Studies UC I og UC II)
| Undersøg uc i | Undersøg uc iI | |||||
| Placebo | 5 mg/kg Infliximab | 10 mg/kg Infliximab | Placebo | 5 mg/kg Infliximab | 10 mg/kg Infliximab | |
| Patienter randomiseret | 121 | 121 | 122 | 123 | 121 | 120 |
| Klinisk responsannonce | ||||||
| Uge 8 | 37% | 69%* | 62%* | 29% | 65%* | 69%* |
| Uge 30 | 30% | 52%* | 51%** | 26% | 47%* | 60%* |
| Uge 54 | 20% | 45%* | 44%* | Na | Na | Na |
| Vedvarende responsd | ||||||
| (Klinisk respons på både uger 8 og 30) | 23% | 49%* | 46%* | 15% | 41%* | 53%* |
| (Klinisk respons i uger 8 30 og 54) | 14% | 39%* | 37%* | Na | Na | Na |
| Klinisk remissionb d | ||||||
| Uge 8 | 15% | 39%* | 32%** | 6% | 34%* | 28%* |
| Uge 30 | 16% | 34%** | 37%* | 11% | 26%** | 36%* |
| Uge 54 | 17% | 35%** | 34%** | Na | Na | Na |
| Vedvarende remissiond | ||||||
| (Klinisk remission ved både uger 8 og 30) | 8% | 23%** | 26%* | 2% | 15%* | 23%* |
| (Klinisk remission i uger 8 30 og 54) | 7% | 20%** | 20%** | Na | Na | Na |
| Slimhindehelingcd | ||||||
| Uge 8 | 34% | 62%* | 59%* | 31% | 60%* | 62%* |
| Uge 30 | 25% | 50%* | 49%* | 30% | 46%** | 57%* |
| Uge 54 | 18% | 45%* | 47%* | Na | Na | Na |
| * S<0.001** S<0.01 a Defineret som et fald fra baseline i mayo -score med ≥30% og ≥3 point ledsaget af et fald i den rektale blødningssubscore på ≥1 eller en rektal blødning underkore på 0 eller 1. (Mayo -score består af summen af fire undercore: afføring frekvensrektal blødning af fysikernes globale vurdering og endoscopy -fund). b Defineret som en mayo -score ≤2 point Ingen individuel underkore> 1. c Defineret som en 0 eller 1 på den endoskopi -undercore af mayo -score. d Patienter, der havde en forbudt ændring i medicin, havde en stomi eller colektomi eller ophørte undersøgelsesinfusioner på grund af manglende effektivitet anses for ikke at være i klinisk respons klinisk remission eller slimhindeheling fra tidspunktet for begivenheden og fremefter. |
Forbedringen med infliximab var konsistent på tværs af alle mayo -underskorer gennem uge 54 (undersøgelse UC I vist i tabel 6; undersøgelse UC II til uge 30 var lignende).
Tabel 6: Andel af voksne UC -patienter i undersøgelse UC I med mayo -underskorer, der indikerer inaktiv eller mild sygdom gennem uge 54
| Undersøg uc i | |||
| Placebo (n = 121) | Infliximab | ||
| 5 mg/kg (n = 121) | 10 mg/kg (n = 122) | ||
| Afføringsfrekvens | |||
| Baseline | 17% | 17% | 10% |
| Uge 8 | 35% | 60% | 58% |
| Uge 30 | 35% | 51% | 53% |
| Uge 54 | 31% | 52% | 51% |
| Rektal blødning | |||
| Baseline | 54% | 40% | 48% |
| Uge 8 | 74% | 86% | 80% |
| Uge 30 | 65% | 74% | 71% |
| Uge 54 | 62% | 69% | 67% |
| Læge's globale vurdering | |||
| Baseline | 4% | 6% | 3% |
| Uge 8 | 44% | 74% | 64% |
| Uge 30 | 36% | 57% | 55% |
| Uge 54 | 26% | 53% | 53% |
| Endoskopi -fund | |||
| Baseline | 0% | 0% | 0% |
| Uge 8 | 34% | 62% | 59% |
| Uge 30 | 26% | 51% | 52% |
| Uge 54 | 21% | 50% | 51% |
Pædiatrisk ulcerøs colitis
Sikkerheden og effektiviteten af infliximab til reduktion af tegn og symptomer og induktion og opretholdelse af klinisk remission hos pædiatriske patienter i alderen 6 år og ældre med moderat til alvorligt aktive UC, der har haft en utilstrækkelig respons på konventionel terapi, understøttes af beviser fra tilstrækkelige og velstyrede undersøgelser af infliximab hos voksne. Yderligere sikkerheds- og farmakokinetiske data blev indsamlet i et åbent pædiatrisk UC-forsøg på 60 pædiatriske patienter i alderen 6 til 17 år (medianalder 14,5 år) med moderat til alvorligt aktiv UC (mayo-score på 6 til 12; endoskopisk underskore ≥2) og en utilstrækkelig reaktion på konventionelle terapier. Ved baseline var median mayo-score 8 53% af patienterne modtog immunmodulatorterapi (6-MP/AZA/MTX), og 62% af patienterne modtog kortikosteroider (median dosis 0,5 mg/kg/dag i prednisonækvivalenter). Seponering af immunmodulatorer og kortikosteroid -konisk var tilladt efter uge 0.
Alle patienter modtog induktionsdosering på 5 mg/kg infliximab i uger 0 2 og 6. Patienter, der ikke svarede på infliximab i uge 8, modtog ingen yderligere infliximab og vendte tilbage til sikkerhedsopfølgning. I uge blev 8 45 patienter randomiseret til en vedligeholdelsesregime på 5 mg/kg infliximab givet enten hver 8. uge til uge 46 eller hver 12. uge til uge 42. Patienter fik lov til at ændre sig til en højere dosis og/eller hyppigere administrationsplan, hvis de oplevede tab af respons.
Klinisk respons i uge 8 blev defineret som et fald fra baseline i mayo -score med ≥30% og ≥3 point inklusive et fald i den rektale blødning underkore med ≥1 point eller opnåelse af en rektal blødning underkore på 0 eller 1.
Klinisk remission i uge 8 blev målt ved mayo -score defineret som en mayo -score på ≤2 point uden nogen individuel undercore> 1. Klinisk remission blev også vurderet i uge 8 og uge 54 ved hjælp af den pædiatriske ulcerøs colitis aktivitetsindeks (Pucai)1 score og blev defineret af en Pucai -score på <10 points.
Endoskopier blev udført ved baseline og i uge 8. En mayo -endoskopi -undercore på 0 indikerede normal eller inaktiv sygdom og en undercore på 1 indikerede mild sygdom (erythema nedsat vaskulært mønster eller mild fritabilitet).
Af de 60 patienter, der blev behandlet 44, var i klinisk respons i uge 8. af 32 patienter, der tog samtidig immunmodulatorer ved baseline 23, opnåede klinisk respons i uge 8 sammenlignet med 21 af 28 af dem, der ikke tager samtidig immunmodulatorer ved baseline. I uge 8 24 af 60 patienter var i klinisk remission målt ved mayo -score, og 17 af 51 patienter var i remission målt ved Pucai -score.
I uge 54 8 af 21 patienter i hver 8-ugers vedligeholdelsesgruppe og 4 af 22 patienter i hver 12-ugers vedligeholdelsesgruppe opnåede remission målt ved Pucai-score.
Under vedligeholdelsesfase 23 af 45 randomiserede patienter (9 i hver 8-ugers gruppe og 14 i hver 12-ugers gruppe) krævede en stigning i deres dosis og/eller stigning i hyppighed af infliximab-administration på grund af tab af respons. Ni af de 23 patienter, der krævede en ændring i dosis, havde opnået remission i uge 54. Syv af disse patienter modtog 10 mg/kg hver 8 ugers dosering.
Reumatoid arthritis
Sikkerheden og effektiviteten af infliximab hos voksne patienter med RA blev vurderet i 2 multicenter randomiserede dobbeltblinde centrale forsøg: tiltrækning (undersøgelse RA I) og aspire (undersøgelse RA II). Samtidig anvendelse af stabile doser af folinsyre orale kortikosteroider (≤10 mg/dag) og/eller ikke-steroide antiinflammatoriske lægemidler (NSAID'er) var tilladt.
Undersøgelse RA I var en placebokontrolleret undersøgelse af 428 patienter med aktiv RA på trods af behandling med MTX. Patienter, der blev tilmeldt, havde en medianalder på 54 års median sygdomsvarighed på 8,4 år median hævet og ømt ledtælling på henholdsvis 20 og 31 og var på en median dosis på 15 mg/vægt MTX. Patienter modtog enten placebo MTX eller en af 4 doser/skemaer af infliximab MTX: 3 mg/kg eller 10 mg/kg infliximab ved IV -infusion i uger 0 2 og 6 efterfulgt af yderligere infusioner hver 4. uge i kombination med MTX.
Undersøgelse RA II var en placebo-kontrolleret undersøgelse af 3 aktive behandlingsarme hos 1004 MTX naive patienter på 3 eller færre år var varighed Active RA. Patienter, der blev tilmeldt, havde en medianalder på 51 år med en median sygdomsvarighed på 0,6 år median hævet og ømt fælles antal på henholdsvis 19 og 31, og> 80% af patienterne havde baseline -ledosioner. Ved randomisering modtog alle patienter MTX (optimeret til 20 mg/wk i uge 8) og enten placebo 3 mg/kg eller 6 mg/kg infliximab i uger 0 2 og 6 og hver 8. uge derefter.
Data on use of Infliximab without concurrent MTX are limited [see Bivirkninger ].
Klinisk respons
I undersøgelsen resulterede i alle doser/tidsplaner for infliximab MTX i forbedring af tegn og symptomer målt ved American College of Rheumatology -responskriterierne (ACR 20) med en højere procentdel af patienter, der opnåede en ACR 20 50 og 70 sammenlignet med placebo MTX (tabel 7). Denne forbedring blev observeret i uge 2 og opretholdt gennem uge 102. Større effekter på hver komponent i ACR 20 blev observeret hos alle patienter behandlet med infliximab MTX sammenlignet med placebo MTX (tabel 8). Flere patienter behandlet med infliximab nåede en større klinisk respons end placebo-behandlede patienter (tabel 7).
I undersøgelse RA II efter 54 ugers behandling resulterede begge doser af infliximab MTX i statistisk signifikant større respons i tegn og symptomer sammenlignet med MTX alene målt ved andelen af patienter, der opnåede ACR 20 50 og 70 responser (tabel 7). Flere patienter behandlet med infliximab nåede en større klinisk respons end placebo-behandlede patienter (tabel 7).
Tabel 7: ACR -respons (procent af patienterne) hos voksne RA -patienter (undersøgelser RA I og RA II)
| Svar | Undersøgelse ra i | Undersøgelse ra iI | ||||||
| Placebo+ MTX (n = 88) | Infliximab+MTX | Placebo+ MTX (n = 274) | Infliximab+MTX | |||||
| 3 mg/kg | 10 mg/kg | 3 mg/kgq 8 wks (n = 351) | 6 mg/kgq 8 uger (n = 355) | |||||
| Q8 WKS (n = 86) | Q4 WKS (n = 86) | Q8 WKS (n = 87) | Q4 WKS (n = 81) | |||||
| ACR 20 | ||||||||
| Uge 30 | 20% | 50%a | 50%y | 52%y | 58%a | N/a | N/a | N/a |
| Uge 54 | 17% | 42%a | 48%y | 59%y | 59%a | 54% | 62%c | 66%a |
| ACR 50 | ||||||||
| Uge 30 | 5% | 27%a | 29%y | 31%y | 26%a | N/a | N/a | N/a |
| Uge 54 | 9% | 21%c | 34%y | 40%y | 38%a | 32% | 46%a | 50%a |
| ACR 70 | ||||||||
| Uge 30 | 0% | 8%b | 11%b | 18%y | 11%a | N/a | N/a | N/a |
| Uge 54 | 2% | 11%c | 18%a | 26%y | 19%a | 21% | 33%b | 37%a |
| Større klinisk respons | 0% | 7%c | 8%b | 15%a | 6%c | 8% | 12% | 17%a |
| a P≤0.001 b P<0.01 c P<0.05 |
Tabel 8: Komponenter i ACR 20 ved baseline og 54 uger (undersøgelse RA I)
| Parameter (medianer) | Placebo+MTX (n = 88) | Infliximab+MTXa (n = 340) | ||
| Baseline | Uge 54 | Baseline | Uge 54 | |
| Antal ømme led | 24 | 16 | 32 | 8 |
| Antal hævede led | 19 | 13 | 20 | 7 |
| Smerteb | 6.7 | 6.1 | 6.8 | 3.3 |
| Læge's globale vurderingb | 6.5 | 5.2 | 6.2 | 2.1 |
| Patientens globale vurderingb | 6.2 | 6.2 | 6.3 | 3.2 |
| Handicap Index (HAQ-D)c | 1.8 | 1.5 | 1.8 | 1.3 |
| CRP (Mg/DL) | 3.0 | 2.3 | 2.4 | 0.6 |
| a Alle doser/tidsplaner af infliximab MTX b Visual Analog Scale (0 = Bedste 10 = værst) cSundhedsvurderingsspørgeskema Måling af 8 kategorier: Dressing og pleje, der opstår at spise vandrende hygiejne rækkevidde greb og aktiviteter (0 = bedste 3 = værst) |
Radiografisk respons
Strukturel skade i både hænder og fødder blev vurderet radiografisk i uge 54 ved ændringen fra baseline i van der Heijde-modificeret skarp (VDH-S) score en sammensat score af strukturel skade, der måler antallet og størrelsen af leddete erosioner og graden af fælles rumindvikling i hænder/håndter og fødder.
I undersøgelsen havde RA i ca. 80% af patienterne parret røntgendata ved 54 uger og ca. 70% efter 102 uger. Inhiberingen af progression af strukturel skade blev observeret ved 54 uger (tabel 9) og opretholdt gennem 102 uger.
I undersøgelsen havde RA II> 90% af patienterne mindst 2 evaluerbare røntgenstråler. Inhibering af progression af strukturel skade blev observeret i uger 30 og 54 (tabel 9) i infliximab MTX -grupperne sammenlignet med MTX alene. Patienter behandlet med infliximab MTX demonstrerede mindre progression af strukturelle skader sammenlignet med MTX alene, uanset om baseline akutte fase-reaktanter (ESR og CRP) var normale eller forhøjede: patienter med forhøjede baseline akutte fase-reaktanter behandlet med MTX alene demonstrerede en gennemsnitlig progression i VDH-S-score på 4,2 enheder sammenlignet med patienter behandlet med infliximab MTX, der demonstrerede 0,5 UNDER på Progression i Progression; Patienter med normal baseline-akutte fase-reaktanter, der blev behandlet med MTX alene, demonstrerede en gennemsnitlig progression i VDH-S-score på 1,8 enheder sammenlignet med infliximab MTX, der demonstrerede 0,2 enheder af progression. Af patienter, der modtog infliximab MTX 59%, havde ingen progression (VDH-S-score ≤0 enhed) af strukturel skade sammenlignet med 45% af patienterne, der fik MTX alene. I en undergruppe af patienter, der begyndte undersøgelsen uden erosioner, opretholdt infliximab MTX en erosionsfri tilstand på 1 år i en større andel af patienterne end MTX alene 79% (77/98) mod 58% (23/40)<0.01). Fewer patients in the Infliximab+MTX groups (47%) developed erosions in uninvolved joints compared to MTX alone (59%).
Tabel 9: Radiografisk ændring fra baseline til uge 54 hos voksne RA -patienter (undersøgelser RA I og RA II)
| Undersøgelse ra i | Undersøgelse ra iI | |||||
| Placebo+MTX (n = 64) | Infliximab+MTX | Placebo+MTX (n = 282) | Infliximab+MTX | |||
| 3 mg/kg Q8 WKS (n = 71) | 10 mg/kg Q8 WKS (n = 77) | 3 mg/kg Q8 WKS (n = 359) | 6 mg/kg q8 wks (n = 363) | |||
| Total score | ||||||
| Baseline | ||||||
| Betyde | 79 | 78 | 65 | 11.3 | 11.6 | 11.2 |
| Median | 55 | 57 | 56 | 5.1 | 5.2 | 5.3 |
| Skift fra baseline | ||||||
| Betyde | 6.9 | 1.3a | 0.2a | 3.7 | 0.4a | 0.5a |
| Median | 4.0 | 0.5 | 0.5 | 0.4 | 0.0 | 0.0 |
| Erosion score | ||||||
| Baseline | ||||||
| Betyde | 44 | 44 | 33 | 8.3 | 8.8 | 8.3 |
| Median | 25 | 29 | 22 | 3.0 | 3.8 | 3.8 |
| Skift fra baseline | ||||||
| Betyde | 4.1 | 0.2a | 0.2a | 3.0 | 0.3a | 0.1a |
| Median | 2.0 | 0.0 | 0.5 | 0.3 | 0.0 | 0.0 |
| JSN -score | ||||||
| Baseline | ||||||
| Betyde | 36 | 34 | 31 | 3.0 | 2.9 | 2.9 |
| Median | 26 | 29 | 24 | 1.0 | 1.0 | 1.0 |
| Skift fra baseline | ||||||
| Betyde | 2.9 | 1.1a | 0.0a | 0.6 | 0.1a | 0.2 |
| Median | 1.5 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 |
| a P<0.001 for each outcome against placebo. |
Fysisk funktionsrespons
Fysisk funktion og handicap blev vurderet ved hjælp af sundhedsvurderingsspørgeskemaet (HAQ-DI) og den generelle sundhedsrelaterede livskvalitetsspørgeskema SF-36.
I undersøgelse RA I alle doser/tidsplaner af infliximab MTX viste signifikant større forbedring fra baseline i HAQ-DI og SF-36 fysisk komponentoversigts score i gennemsnit gennem tid til uge 54 sammenlignet med placebo MTX og ingen forværring i SF-36 mental komponentens resume af komponenten. Den median (interkvartil rækkevidde) forbedring fra baseline til uge 54 i HAQ-DI var 0,1 (-0,1 0,5) for placebo MTX-gruppen og 0,4 (0,1 0,9) for infliximab MTX (P<0.001). Both HAQ-DI og SF-36 effects were maintained through Week 102. Approximately 80% of patients in all doses/schedules of Infliximab+MTX remained in the trial through 102 weeks.
I undersøgelsen viste RA II begge infliximab-behandlingsgrupper større forbedring af HAQ-DI fra baseline i gennemsnit over tid til uge 54 sammenlignet med MTX alene; 0,7 for infliximab MTX vs. 0,6 for MTX alene (p≤0,001). Der blev ikke observeret nogen forværring i den SF-36 mentale komponentoversigtsresultat.
Ankyloserende spondylitis
Sikkerheden og effektiviteten af infliximab blev vurderet i en randomiseret multicenter dobbeltblind placebokontrolleret undersøgelse hos 279 voksne patienter med aktiv AS. Patienterne var mellem 18 og 74 år og havde som defineret ved de modificerede New York -kriterier for ankyloserende spondylitis. Patienter skulle have haft aktiv sygdom, som det fremgår af både et bad ankyloserende spondylitis sygdomsaktivitetsindeks (BASDAI) score> 4 (mulig interval 0-10) og spinalmerter> 4 (i en visuel analog skala [VAS] på 0-10). Patienter med komplet ankylose af rygsøjlen blev udelukket fra undersøgelsesdeltagelse, og brugen af sygdom, der modificerede anti-rheumatiske lægemidler (DMARD'er), og systemiske kortikosteroider blev forbudt. Doser af infliximab 5 mg/kg eller placebo blev administreret intravenøst i uger 0 2 6 12 og 18.
Ved 24 ugers forbedring af tegnene og symptomerne på som målt ved andelen af patienter, der opnåede en forbedring på 20% i ASAS-responskriterier (ASAS 20), blev set hos 60% af patienterne i den infliximab-behandlede gruppe mod 18% af patienterne i placebogruppen (P<0.001). Improvement was observed at Week 2 og maintained through Uge 24 (Figure 3 og Table 10).
Figur 3: Andel af voksne som patienter, der opnåede et ASAS 20 -svar
 |
Efter 24 uger var andelene af patienter, der opnår 50% og en forbedring på 70% i tegn og symptomer på som målt ved henholdsvis ASAS -responskriterier (henholdsvis ASAS 50 og ASAS 70)<0.001 Infliximab vs. placebo). A low level of disease activity (defined as a value <20 [on a scale of 0-100 mm] in each of the 4 ASAS response parameters) was achieved in 22% of Infliximab-treated patients vs. 1% in placebo-treated patients (P<0.001).
Tabel 10: Komponenter i As Disease Activity
| Placebo (n = 78) | Infliximab 5 mg/kg (n = 201) | P-værdi | |||
| Baseline | 24 uger | Baseline | 24 uger | ||
| Vinger 20 svar | |||||
| Kriterier (gennemsnit) | |||||
| Patientens globale vurderinga | 6.6 | 6.0 | 6.8 | 3.8 | <0.001 |
| Spinal smertea | 7.3 | 6.5 | 7.6 | 4.0 | <0.001 |
| Basfib | 5.8 | 5.6 | 5.7 | 3.6 | <0.001 |
| Betændelsec | 6.9 | 5.8 | 6.9 | 3.4 | <0.001 |
| Akutte fase -reaktanter | |||||
| Median CRPd (mg/dl) | 1.7 | 1.5 | 1.5 | 0.4 | <0.001 |
| Spinal mobilitet (CM -middelværdi) | |||||
| Ændret Schobers teste | 4.0 | 5.0 | 4.3 | 4.4 | 0.75 |
| Brystudvidelsee | 3.6 | 3.7 | 3.3 | 3.9 | 0.04 |
| Tragus til væge | 17.3 | 17.4 | 16.9 | 15.7 | 0.02 |
| Lateral rygmarvsflexione | 10.6 | 11.0 | 11.4 | 12.9 | 0.03 |
| a Målt på en vas med 0 = ingen og 10 = svær b Bath Ankylosing Spondylitis Functional Index (BASFI) Gennemsnit på 10 spørgsmål c Betændelse average of last 2 questions on the 6-question BASDAI d CRP Normal interval 0-1,0 mg/dl e Spinal mobilitet Normale værdier: Ændret Schober's test:> 4 cm; Brystudvidelse:> 6 cm; tragus til væg: <15 cm; lateral spinal flexion:>10 cm |
Medianforbedringen fra baseline i den generelle sundhedsrelaterede livskvalitetsspørgeskema SF-36 Fysisk komponentoversigt i uge 24 var 10,2 for infliximab-gruppen mod 0,8 for placebogruppen (P<0.001). There was no change in the SF-36 mental component summary score in either the Infliximab group or the placebo group.
Resultaterne af denne undersøgelse svarede til dem, der blev set i en multicenter dobbeltblind placebokontrolleret undersøgelse af 70 patienter med AS.
Psoriasis arthritis
Sikkerhed og effektivitet af infliximab blev vurderet i en multicenter dobbeltblind placebokontrolleret undersøgelse hos 200 voksne patienter med aktiv PSA på trods af DMARD eller NSAID-terapi (≥5 hævede led og ≥5 ømme led) med 1 eller flere af følgende subtypes: arthritis, der involverer dipfuger (n = 49) artritis mumilans (n = 3) asymmemmhmhmhmhmhmhmal Peripmuly Arthritis (n = 40) polyartikulær arthritis (n = 100) og spondylitis med perifer arthritis (n = 8). Patienter havde også PS med en kvalificerende mållæsion ≥2 cm i diameter. Seksogfyrre procent af patienterne fortsatte med stabile doser af methotrexat (≤25 mg/uge). I løbet af den 24-ugers dobbeltblinde fase modtog patienter enten 5 mg/kg infliximab eller placebo i uger 0 2 6 14 og 22 (100 patienter i hver gruppe). I uge 16 placebo -patienter med <10% improvement from baseline in both swollen og tender joint counts were switched to Infliximab induction (early escape). At Uge 24 all placebo-treated patients crossed over to Infliximab induction. Dosing continued for all patients through Week 46.
Klinisk respons
Behandling med infliximab resulterede i forbedring af tegn og symptomer som vurderet af ACR-kriterierne med 58% af infliximab-behandlede patienter, der opnåede ACR 20 i uge 14 sammenlignet med 11% af placebo-behandlede patienter (P<0.001). The response was similar regardless of concomitant use of methotrexate. Improvement was observed as early as Week 2. At 6 months the ACR 20/50/70 responses were achieved by 54% 41% og 27% respectively of patients receiving Infliximab compared to 16% 4% og 2% respectively of patients receiving placebo. Similar responses were seen in patients with each of the subtypes of PsA although few patients were enrolled with the arthritis mutilans og spondylitis with peripheral arthritis subtypes.
Sammenlignet med placebo -behandling med infliximab resulterede i forbedringer i komponenterne i ACR -responskriterierne såvel som i dactylitis og enthesopati (tabel 11). Den kliniske respons blev opretholdt gennem uge 54. Lignende ACR-svar blev observeret i en tidligere randomiseret placebokontrolleret undersøgelse af 104 PSA-patienter, og svarene blev opretholdt gennem 98 uger i en open-label-forlængelsesfase.
Tabel 11: Komponenter i ACR 20 og procentdel af voksne PSA -patienter med 1 eller flere led med dactylitis og procentdel af voksne PSA -patienter med enthesopati ved baseline og uge 24
| Patienter randomiseret | Placebo (n = 100) | Infliximab 5 mg/kga (n = 100) | ||
| Baseline | Uge 24 | Baseline | Uge 24 | |
| Parameter (medianer) | ||||
| Antal ømme ledb | 24 | 20 | 20 | 6 |
| Antal hævede ledc | 12 | 9 | 12 | 3 |
| Smerted | 6.4 | 5.6 | 5.9 | 2.6 |
| Læge's globale vurderingd | 6.0 | 4.5 | 5.6 | 1.5 |
| Patientens globale vurderingd | 6.1 | 5.0 | 5.9 | 2.5 |
| Handicap Index (HAQ-D)e | 1.1 | 1.1 | 1.1 | 0.5 |
| CRP (Mg/DL)f | 1.2 | 0.9 | 1.0 | 0.4 |
| % Patienter med 1 eller flere cifre med dactylitis | 41 | 33 | 40 | 15 |
| % Patienter med enthesopati | 35 | 36 | 42 | 22 |
| a P<0.001 for percent change from baseline in all components of ACR 20 at Uge 24 P<0.05 for % of patients with dactylitis og P=0.004 for % of patients with enthesopathy at Uge 24 b Skala 0-68 c Skala 0-66 d Visual Analog Scale (0 = Bedste 10 = værst) e Sundhedsvurderingsspørgeskema Måling af 8 kategorier: Dressing og pleje, der opstår at spise vandrende hygiejne rækkevidde greb og aktiviteter (0 = bedste 3 = værst) f Normalt interval 0-0,6 mg/dl |
Forbedring i Psoriasis-området og sværhedsindekset (PASI) hos PSA-patienter med baseline-kropsoverfladeareal (BSA) ≥3% (n = 87 placebo N = 83 infliximab) blev opnået ved uge 14 uanset samtidig methotrexat anvendelse med 64% af infliximab-behandlinger, der opnåede mindst 75% forbedring af basiselinen mod 2% placering af placering af placering af patienter; Forbedring blev observeret hos nogle patienter allerede i uge 2. efter 6 måneder, PASI 75 og PASI 90 -svar blev opnået med henholdsvis 60% og 39% af patienter, der fik infliximab sammenlignet med henholdsvis 1% og 0% af patienter, der modtog placebo. Pasi -svaret blev generelt opretholdt gennem uge 54. [Se Kliniske studier ].
Radiografisk respons
Strukturel skade i både hænder og fødder blev vurderet radiografisk ved ændringen fra baseline i van der Heijde-Sharp (VDH-S) score modificeret ved tilsætning af hånddipeled. Den samlede modificerede VDH-S-score er en sammensat score af strukturel skade, der måler antallet og størrelsen af led erosioner og graden af fælles pladsindvikling (JSN) i hænder og fødder. I uge 24 havde infliximab-behandlede patienter mindre radiografisk progression end placebo-behandlede patienter (gennemsnitlig ændring på -0,70 mod 0,82 p<0.001). Infliximab-treated patients also hannonce less progression in their erosion scores (-0.56 vs 0.51) og JSN scores (-0.14 vs 0.31). The patients in the Infliximab group demonstrated continued inhibition of structural damage at Uge 54. Most patients showed little or no change in the vdH-S score during this 12-month study (median change of 0 in both patients who initially received Infliximab or placebo). More patients in the placebo group (12%) hannonce reannonceily apparent rannonceiographic progression compared with the Infliximab group (3%).
Fysisk funktion
Fysisk funktionsstatus blev vurderet ved hjælp af HAQ Disability Index (HAQ-DI) og SFâ36 Health Survey. Infliximab-behandlede patienter demonstrerede signifikant forbedring i fysisk funktion som vurderet af HAQ-DI (medianprocentforbedring i HAQ-DI-score fra baseline til uge 14 og 24 på 43% for infliximab-behandlede patienter mod 0% for placebo-behandlede patienter).
Under den placebokontrollerede del af forsøget (24 uger) opnåede 54% af infliximab-behandlede patienter en klinisk meningsfuld forbedring i HAQ-DI (≥0,3 enhedsfald) sammenlignet med 22% af placebo-behandlede patienter. Infliximab-behandlede patienter demonstrerede også større forbedring af SF-36 fysiske og mentale komponentens resume af scoringer end placebo-behandlede patienter. Svarene blev opretholdt i op til 2 år i en open-label-udvidelsesundersøgelse.
Plaque psoriasis
Sikkerheden og effektiviteten af infliximab blev vurderet i 3 randomiserede dobbeltblinde placebokontrollerede studier hos patienter 18 år og ældre med kronisk stabil PS, der involverede ≥10% BSA et minimum PASI-score på 12 og som var kandidater til systemisk terapi eller fototerapi. Patienter med guttatpustulær eller erythrodermisk psoriasis blev udelukket fra disse undersøgelser. Ingen samtidige anti-psoriatiske terapier blev tilladt under undersøgelsen med undtagelse af topiske kortikosteroider med lav potency i ansigtet og lysken efter uge 10 i studieinitiering.
Undersøgelse I (Express) evaluerede 378 patienter, der modtog placebo eller infliximab i en dosis på 5 mg/kg i uger 0 2 og 6 (induktionsterapi) efterfulgt af vedligeholdelsesbehandling hver 8. uge. I uge 24 krydsede placebogruppen over til infliximab -induktionsterapi (5 mg/kg) efterfulgt af vedligeholdelsesbehandling hver 8. uge. Patienter, der oprindeligt blev randomiseret til infliximab, fortsatte med at modtage infliximab 5 mg/kg hver 8. uge til uge 46. På tværs af alle behandlingsgrupper var median baseline Pasi -score 21 og baseline statisk læge global vurdering (SPGA) score varierede fra moderat (52%af patienterne) til markeret (36%) til svær (2%). Derudover havde 75% af patienterne en BSA> 20%. Enoghalvfjerds procent af patienterne modtog tidligere systemisk terapi og 82% modtog fototerapi.
Undersøgelse II (Express II) evaluerede 835 patienter, der modtog placebo eller infliximab ved doser på 3 mg/kg eller 5 mg/kg ved uge 0 2 og 6 (induktionsterapi). I uge 14 inden for hver infliximab -dosisgruppe blev patienter randomiseret til enten planlagt (hver 8. uge) eller efter behov (PRN) vedligeholdelsesbehandling gennem uge 46. I uge 16 krydsede placebogruppen til infliximab -induktionsterapi (5 mg/kg) efterfulgt af vedligeholdelsesbehandling hver 8. uge. På tværs af alle behandlingsgrupper var median baseline PASI -score 18 og 63% af patienterne havde en BSA> 20%. Femogtyve procent af patienterne modtog tidligere systemisk terapi og 64% fik en fototerapi.
Undersøgelse III (Spirit) evaluerede 249 patienter, der tidligere havde modtaget enten psoralen plus ultraviolet en behandling ( Puva ) eller anden systemisk terapi til deres psoriasis. Disse patienter blev randomiseret til at modtage enten placebo eller infliximab ved doser på 3 mg/kg eller 5 mg/kg i uger 0 2 og 6. Ved uge 26 modtog patienter med en SPGA -score med moderat eller værre (større end eller lig med 3 i en skala fra 0 til 5) en yderligere dosis af den randomiserede behandling. På tværs af alle behandlingsgrupper var median baseline PASI -score 19 og baseline SPGA -score varierede fra moderat (62%af patienterne) til markeret (22%) til svær (3%). Derudover havde 75% af patienterne en BSA> 20%. Af de tilmeldte patienter modtog 114 (46%) ugen 26 yderligere dosis.
I undersøgelser I II og III var det primære slutpunkt andelen af patienter, der opnåede en reduktion i score på mindst 75% fra baseline i uge 10 af PASI (PASI 75). I undersøgelse I og undersøgelse III omfattede et andet evalueret resultat andelen af patienter, der opnåede en score af ryddet eller minimal af SPGA. SPGA er en 6-kategori skala, der spænder fra 5 = svær til 0 = ryddet, hvilket indikerer lægens samlede vurdering af psoriasis-sværhedsgraden med fokus på induration erythema og skalering. Behandlingssucces defineret som ryddet eller minimal bestod af ingen eller minimal højde i plak op til svag rød farve i erythema og ingen eller minimal fin skala over <5% of the plaque.
Undersøgelse II vurderede også andelen af patienter, der opnåede en score af klar eller fremragende af den relative læges globale vurdering (RPGA). RPGA er en 6-kategori skala, der spænder fra 6 = værre til 1 = klar, der blev vurderet i forhold til baseline. Generelle læsioner blev klassificeret med hensyn til procentdelen af kropsinddragelse såvel som den samlede indurationsskalering og erythema. Behandlingssucces defineret som klar eller fremragende bestod af en vis resterende pinkness eller pigmentering til markant forbedring (næsten normal hudtekstur; nogle erytem kan være til stede). Resultaterne af disse undersøgelser er præsenteret i tabel 12.
Tabel 12: Psoriasisundersøgelser i voksne I II og III Procentdel af patienter, der opnåede Pasi 75 og procentdel, der opnåede behandlingssucces med lægens globale vurdering i uge 10
| Placebo | Infliximab | ||
| 3 mg/kg | 5 mg/kg | ||
| Psoriasis -undersøgelse I - Patienter randomisereta | 77 | — | 301 |
| Efter 75 | 2 (3%) | — | 242 (80%)* |
| SPGA | 3 (4%) | — | 242 (80%)* |
| Psoriasis Study II - Patienter randomisereta | 208 | 313 | 314 |
| Efter 75 | 4 (2%) | 220 (70%)* | 237 (75%)* |
| RPGA | 2 (1%) | 217 (69%)* | 234 (75%)* |
| Psoriasis Study III - Patienter randomiseretb | 51 | 99 | 99 |
| Efter 75 | 3 (6%) | 71 (72%)* | 87 (88%)* |
| SPGA | 5 (10%) | 71 (72%)* | 89 (90%)* |
| * S<0.001 compared with placebo a Patienter med manglende data i uge 10 blev betragtet som ikke -svar. b Patienter med manglende data i uge 10 blev beregnet ved sidste observation. |
I undersøgelse I i undergruppen af patienter med mere omfattende PS, der tidligere havde modtaget fototerapi 85% af patienterne på 5 mg/kg infliximab opnåede en PASI 75 i uge 10 sammenlignet med 4% af patienterne på placebo.
I undersøgelse II i undergruppen af patienter med mere omfattende PS, der tidligere havde modtaget fototerapi 72% og 77% af patienterne på 3 mg/kg og 5 mg/kg infliximab opnåede en PASI 75 i uge 10 sammenlignet med 1% på placebo. I undersøgelse II blandt patienter med mere omfattende PS, der havde mislykkedes eller var intolerante over for fototerapi 70% og 78% af patienterne på 3 mg/kg og 5 mg/kg infliximab opnåede en PASI 75 i uge 10 sammenlignet med 2% på placebo.
Vedligeholdelse af respons blev undersøgt i en undergruppe af 292 og 297 infliximab-behandlede patienter i de 3 mg/kg og 5 mg/kg grupper; henholdsvis i undersøgelse II. Stratificeret af PASI-respons i uge 10 og patienter med undersøgelsessted i de aktive behandlingsgrupper blev randomiseret igen til enten en planlagt eller efter behov (PRN) terapi, der begyndte i uge 14.
De grupper, der modtog en vedligeholdelsesdosis hver 8. uge, ser ud til at have en større procentdel af patienter, der opretholder en PASI 75 til uge 50 sammenlignet med patienter, der modtog de efterfølgende eller PRN-doser, og den bedste respons blev opretholdt med 5 mg/kg hver 8-ugers dosis. Disse resultater er vist i figur 4. i uge 46, hvor infliximab-serumkoncentrationer var på trugiveau i hver 8-ugers dosisgruppe 54% af patienterne i 5 mg/kg-gruppen sammenlignet med 36% i 3 mg/kg-gruppen opnåede PASI 75. Den nedre procentdel af PASI 75 respondere i 3 mg/kg hver 8-uger af patienter med detekterbare trug seruminfliximab -niveauer. Dette kan delvis være relateret til højere antistofrater [se Bivirkninger ]. In annoncedition in a subset of patients who hannonce achieved a response at Week 10 maintenance of response appears to be greater in patients who received Infliximab every 8 weeks at the 5 mg/kg dose. Regardless of whether the maintenance doses are PRN or every 8 weeks there is a decline in response in a subpopulation of patients in each group over time.
Resultaterne af undersøgelse I til uge 50 i 5 mg/kg hver 8. uge vedligeholdelsesdosisgruppe svarede til resultaterne fra undersøgelse II.
Figur 4: Andel af voksne PS -patienter, der opnåede ≥75% forbedring i PASI fra baseline til uge 50 (patienter randomiseret i uge 14)
 |
Effektivitet og sikkerhed ved infliximab -behandling ud over 50 uger er ikke blevet evalueret hos patienter med PS.
Referencer
1. Turner D Otley Ar Mack D et al. Udviklingsvalidering og evaluering af et pædiatrisk ulcerøs colitis -aktivitetsindeks: En potentiel multicenterundersøgelse. Gastroenterologi. 2007; 133: 423432.
Patientinformation til Remicade
Infliximab
Til injektion til intravenøs brug
Læs medicinguiden, der følger med infliximab, før du modtager den første behandling, og inden hver gang får du en behandling af infliximab. Denne medicinguide indtager ikke stedet for at tale med din læge om din medicinske tilstand eller behandling.
Hvad er de vigtigste oplysninger, jeg skal vide om infliximab?
Infliximab may cause serious side effects including:
1. Risiko for infektion
Infliximab is a medicine that affects your immune system. Infliximab can lower the ability of your immune system to fight infections. Serious infections have happened in patients receiving Infliximab.
Disse infektioner inkluderer tuberkulose (TB) og infektioner forårsaget af vira svampe eller bakterier, der har spredt sig over hele kroppen. Nogle patienter er døde af disse infektioner.
- Din læge skal teste dig for TB, inden du starter infliximab.
- Din læge skal overvåge dig nøje for tegn og symptomer på TB under behandling med infliximab.
Før du starter infliximab, fortæl din læge, hvis du:
- Tror du har en infektion. Du skal ikke begynde at modtage infliximab, hvis du har nogen form for infektion.
- behandles for en infektion.
- har tegn på en infektion, såsom en feberhoste-influenzalignende symptomer.
- Har åbne snit eller sår på din krop.
- Få en masse infektioner eller har infektioner, der fortsætter med at vende tilbage.
- har diabetes eller et immunsystemproblem. Mennesker med disse forhold har en større chance for infektioner.
- har TB eller har været i tæt kontakt med nogen med TB.
- Live eller har boet i visse dele af landet (såsom Ohio og Mississippi River Valleys), hvor der er en øget risiko for at få visse former for svampeinfektioner (histoplasmosis coccidioidomycosis eller blastomycosis). Disse infektioner kan udvikle sig eller blive mere alvorlige, hvis du modtager infliximab. Hvis du ikke ved, om du har boet i et område, hvor histoplasmosis coccidioidomycosis eller blastomycosis er almindelig, så spørg din læge.
- har eller har haft hepatitis B.
- Brug medicinen Kineret (Anakinra) Orencia (Abatacept) Actemra (TOCILIZUZUMAB) eller andre lægemidler kaldet biologi, der bruges til at behandle de samme betingelser som infliximab.
Efter at have startet infliximab Hvis du har en infektion, tegn et tegn på en infektion, der inkluderer en feberhoste-influenzalignende symptomer eller har åbne snit eller sår på din krop, skal du straks ringe til din læge. Infliximab kan gøre dig mere tilbøjelig til at få infektioner eller gøre enhver infektion, som du har værre.
2. Risiko for kræft
- Der har været tilfælde af usædvanlige kræftformer hos børn og teenagepatienter, der bruger tumor nekrose faktor (TNF) blokeringsmediciner.
- For børn og voksne, der modtager TNF -blokkeringsmediciner, inklusive infliximab, kan chancerne for at få lymfom eller andre kræftformer stige.
- Nogle mennesker, der modtager TNF-blokkeere, inklusive infliximab, udviklede en sjælden type kræft kaldet hepatosplenisk T-celle lymfom. Denne type kræft resulterer ofte i død. De fleste af disse mennesker var mandlige teenagere eller unge mænd. De fleste mennesker blev også behandlet for Crohns sygdom eller ulcerøs colitis med en TNF -blokering og en anden medicin kaldet azathioprine eller 6mercaptopurine.
- Mennesker, der er blevet behandlet for reumatoid arthritis Crohns sygdoms ulcerøs colitis ankyloserende spondylitis psoriasisartritis og plakksoriasis i lang tid kan være mere tilbøjelige til at udvikle lymfom. Dette gælder især for mennesker med meget aktiv sygdom.
- Nogle mennesker behandlet med infliximab har udviklet visse former for hudkræft. Hvis ændringer i udseendet af din hud eller vækst på din hud forekommer under eller efter din behandling med infliximab, fortæl din læge.
- Patienter med kronisk obstruktiv lungesygdom (KOL) En bestemt type lungesygdom kan have en øget risiko for at få kræft, mens de behandles med infliximab.
- Nogle kvinder, der behandles for reumatoid arthritis med infliximab, har udviklet livmoderhalskræft. For kvinder, der modtager infliximab inklusive dem over 60 år, kan din læge anbefale, at du fortsat regelmæssigt bliver screenet for livmoderhalskræft.
- Fortæl din læge, hvis du nogensinde har haft nogen form for kræft. Diskuter med din læge ethvert behov for at justere medicin, du måtte tage.
Se afsnittet Hvad er de mulige bivirkninger af infliximab? Nedenfor for mere information.
Hvad er infliximab?
Infliximab is a prescription medicine that is approved for patients with:
- Reumatoid arthritis -annonceults with moderately to severely active reumatoid arthritis along with the medicine methotrexate.
- Crohns sygdom -børn 6 år og ældre og voksne med Crohns sygdom, som ikke har reageret godt på andre medicin.
- Ankyloserende spondylitis in annonceults
- Psoriasis arthritis in annonceults
- Plaque psoriasis -annonceult patients with Plaque psoriasis that is chronic (does not go away) severe extensive og/or disabling.
- Ulcerøs colitis -children 6 years og older og annonceults with moderately to severely active Ulcerøs colitis who have not responded well to other medicines.
Infliximab blocks the action of a protein in your body called Tumor nekrose faktor-alfa (TNF-alfa). TNF-alpha is mannoncee by your body’s immune system. People with certain diseases have too much TNF-alpha that can cause the immune system to attack normal healthy parts of the body. Infliximab can block the damage caused by too much TNF-alpha.
Det vides ikke, om infliximab er sikker og effektiv hos børn under 6 år.
Hvem skal ikke modtage infliximab?
Du skal ikke modtage infliximab, hvis du har det:
- hjertesvigt unless your doctor has examined you og decided that you are able to receive Infliximab. Talk to your doctor about your hjertesvigt.
- havde en allergisk reaktion på infliximab eller nogen af de andre ingredienser i infliximab. Se slutningen på denne medicinvuide for en komplet liste over ingredienser i infliximab.
Hvad skal jeg fortælle min læge, før jeg starter behandling med infliximab?
Din læge vil vurdere dit helbred inden hver behandling.
Fortæl din læge om alle dine medicinske tilstande, herunder hvis du:
- har en infektion (se Hvad er de vigtigste oplysninger, jeg skal vide om infliximab? ).
- Har andre leverproblemer inklusive leversvigt.
- har hjertesvigt eller andre hjertesygdomme. Hvis du har hjertesvigt, kan det blive værre, mens du modtager infliximab.
- har eller har haft nogen form for kræft.
- har haft fototerapi (behandling med ultraviolet lys eller sollys sammen med en medicin for at gøre din hud følsom over for lys) til psoriasis. Du har muligvis en større chance for at få hudkræft, mens du modtager infliximab.
- har KOLS en bestemt type lungesygdom. Patienter med KOL kan have en øget risiko for at få kræft, mens de modtager infliximab.
- har eller har haft en tilstand, der påvirker dit nervesystem, såsom:
- Multipel sklerose or Guillain-Barré syndrome or
- Hvis du oplever følelsesløshed eller prikken eller
- Hvis du har haft et anfald.
- har for nylig modtaget eller planlagt til at modtage en vaccine. Voksne og børn, der modtager infliximab, bør ikke modtage levende vacciner (for eksempel Bacille Calmette-Gué Rin [BCG] -vaccine) eller behandling med en svækket bakterie (såsom BCG til blærekræft). Voksne og børn skal have alle deres vacciner bragt opdateret, før de startede behandling med infliximab.
- er gravide eller planlægger at blive gravide er amning eller planlægger at amme. Du og din læge skal beslutte, om du skal modtage infliximab, mens du er gravid eller ammer.
Hvis du har en baby, og du modtog infliximab under din graviditet, er det vigtigt at fortælle din babys læge og andre sundhedspersonale om din infliximab -brug, så de kan beslutte, hvornår din baby skal modtage nogen vaccine. Visse vaccinationer kan forårsage infektioner.
Hvis du modtog infliximab, mens du var gravid, kan din baby muligvis have en højere risiko for at få en infektion. Hvis din baby får en levende vaccine inden for 6 måneder efter fødslen, kan din baby udvikle infektioner med alvorlige komplikationer, der kan føre til død. Dette inkluderer levende vacciner som BCG rotavirus eller andre levende vacciner. For andre typer vacciner taler med din læge.
Hvordan skal jeg modtage infliximab?
- Du får infliximab gennem en nål placeret i en vene (IV eller intravenøs infusion) i din arm.
- Din læge kan beslutte at give dig medicin, inden du starter infliximab -infusionen for at forhindre eller mindske bivirkninger.
- Kun en sundhedspersonale skal forberede medicinen og administrere den til dig.
- Infliximab will be given to you over a period of about 2 hours.
- Hvis du har bivirkninger fra infliximab, kan infusionen muligvis justeres eller stoppes. Derudover kan din sundhedspersonale muligvis beslutte at behandle dine symptomer.
- En sundhedspersonale vil overvåge dig under infliximab -infusionen og i en periode bagefter for bivirkninger. Din læge kan muligvis udføre visse tests, mens du modtager infliximab for at overvåge dig for bivirkninger og for at se, hvor godt du reagerer på behandlingen.
- Din læge bestemmer den rigtige dosis af infliximab for dig, og hvor ofte du skal modtage den. Sørg for at diskutere med din læge, når du vil modtage infusioner og komme ind for alle dine infusioner og opfølgningsaftaler.
Hvad skal jeg undgå, mens jeg modtager infliximab?
Tag ikke infliximab sammen med medicin såsom kineret (Anakinra) Orencia (abatacept) actemra (tocilizumab) eller andre lægemidler kaldet biologi, der bruges til at behandle de samme betingelser som infliximab.
Fortæl din læge om alle de medicin, du tager inklusive receptpligtige og over-the-counter medicin vitaminer og urtetilskud. Disse inkluderer alle andre lægemidler til behandling af Crohns sygdoms ulcerøs colitis reumatoid arthritis ankyloserende spondylitis psoriasisartritis eller psoriasis.
Kend de medicin, du tager. Opbevar en liste over dine medicin, og vis dem til din læge og farmaceut, når du får en ny medicin.
Hvad er de mulige bivirkninger af infliximab?
Infliximab can cause serious side effects including:
Se Hvad er de vigtigste oplysninger, jeg skal vide om infliximab?
Alvorlige infektioner
- Nogle patienter, især de 65 år og ældre, har haft alvorlige infektioner, mens de modtog infliximab. Disse alvorlige infektioner inkluderer TB og infektioner forårsaget af vira svampe eller bakterier, der har spredt sig over hele kroppen eller forårsager infektioner i visse områder (såsom hud). Nogle patienter dør af disse infektioner. Hvis du får en infektion, mens du modtager behandling med infliximab, vil din læge behandle din infektion og muligvis være nødt til at stoppe din infliximab -behandling.
- Fortæl din læge med det samme, hvis du har nogen af følgende tegn på en infektion, mens du modtager eller efter at have modtaget infliximab:
- en feber
- har influenzalignende symptomer
- Føl dig meget træt
- varm rød eller smertefuld hud
- har en hoste
- Din læge vil undersøge dig for TB og udføre en test for at se, om du har TB. Hvis din læge føler, at du er i fare for TB, kan du blive behandlet med medicin mod TB, før du begynder behandling med infliximab og under behandling med infliximab.
- Selvom din TB -test er negativ, din læge skal omhyggeligt overvåge dig for TB -infektioner, mens du modtager infliximab. Patienter, der havde en negativ TB -hudtest, før de modtog infliximab, har udviklet aktiv TB.
- Hvis du er en kronisk bærer af hepatitis B -virussen, kan virussen blive aktiv, mens du bliver behandlet med infliximab. I nogle tilfælde er patienter døde som et resultat af, at hepatitis B -virus blev genaktiveret. Din læge skal udføre en blodprøve for hepatitis B -virus, før du starter behandling med infliximab og lejlighedsvis, mens du bliver behandlet. Fortæl din læge, hvis du har nogen af følgende symptomer:
- Føl dig uvel
- træthed (fatigue)
- Dårlig appetit
- feber hududslæt eller ledssmerter
Hjertesvigt
Hvis du har et hjerteproblem kaldet Kongestiv hjertesvigt Din læge skal tjekke dig nøje, mens du modtager infliximab. Din kongestive hjertesvigt kan blive værre, mens du modtager infliximab. Sørg for at fortælle din læge om nye eller værre symptomer, herunder:
- åndenød
- Pludselig vægtøgning
- Hævelse af ankler eller fødder
Behandling med infliximab kan muligvis stoppes, hvis du får ny eller værre kongestiv hjertesvigt.
Andre hjerteproblemer
Nogle patienter har oplevet en hjerteanfald (hvoraf nogle førte til død) lav blodstrøm til hjertet eller unormal hjerterytme inden for 24 timer efter begyndelsen af deres infusion af infliximab. Symptomer kan omfatte ubehag i brystet eller smerter arm smerte mavesmerter af åndenød åndenød fyrtårhed svimmelhed besvimende Svedende kvalme opkastning af fladder eller bankende i brystet og/eller en hurtig eller langsom hjerteslag. Fortæl din læge med det samme, hvis du har nogen af disse symptomer.
Leverskade
Nogle patienter, der modtager infliximab, har udviklet alvorlige leverproblemer. Fortæl din læge, hvis du har:
- gulsot (skin og eyes turning yellow)
- feber
- Mørkebrun-farvet urin
- ekstrem træthed (severe fatigue)
- smerte on the right side of your stomach area(right-sided abdominal smerte)
Blodproblemer
Hos nogle patienter, der får infliximab, kan kroppen muligvis ikke gøre nok af de blodlegemer, der hjælper med at bekæmpe infektioner eller hjælpe med at stoppe blødning. Fortæl din læge, hvis du:
- har feber, der ikke forsvinder
- Se meget bleg ud
- blå mærker eller bløder meget let
Nervesystemforstyrrelser
Nogle patienter, der modtager infliximab, har udviklet problemer med deres nervesystem. Fortæl din læge, hvis du har:
- Ændringer i din vision
- anfald
- følelsesløshed eller prikken in any part of your body
- Svaghed i dine arme eller ben
Nogle patienter har oplevet en stroke within approximately 24 hours of their infusion with Infliximab. Tell your doctor right away if you have symptoms of a stroke which may include: numbness or weakness of the face arm or leg especially on one side of the body; sudden forvirring trouble speaking or understoging; sudden trouble seeing in one or both eyes sudden trouble walking svimmelhed loss of balance or coordination or a sudden severe hovedpine.
Allergiske reaktioner
Nogle patienter har haft allergiske reaktioner på infliximab. Nogle af disse reaktioner var alvorlige. Disse reaktioner kan ske, mens du får din infliximab -behandling eller kort efterpå. Din læge kan være nødt til at stoppe eller sætte din behandling på pause med infliximab og kan give dig medicin til behandling af den allergiske reaktion. Tegn på en allergisk reaktion kan omfatte:
- nældefeber (rød hævede kløende pletter af hud)
- Besvær
- brystsmerter
- høj eller Lavt blodtryk
- feber
- kulderystelser
Nogle patienter, der blev behandlet med infliximab, har haft forsinket allergiske reaktioner. De forsinkede reaktioner forekom 3 til 12 dage efter modtagelse af behandling med infliximab. Fortæl din læge med det samme, hvis du har nogen af disse tegn på forsinket allergisk reaktion på infliximab:
- feber
- udslæt
- hovedpine
- ondt i halsen
- Muskel- eller ledssmerter
- Hævelse af ansigtet og hænderne
- Sværheds vanskeligheder
Lupus-lignende syndrom
Nogle patienter har udviklet symptomer, der ligner symptomerne på lupus. Hvis du udvikler et af følgende symptomer, kan din læge beslutte at stoppe din behandling med infliximab.
- Bryst ubehag eller smerter, der ikke forsvinder
- åndenød
- ledssmerter
- udslæt on the cheeks or arms that gets worse in the sun
Psoriasis
Nogle mennesker, der modtog infliximab, havde ny psoriasis eller forværring af psoriasis, de allerede havde. Fortæl din læge, hvis du udvikler røde skællende pletter eller hævede buler på huden, der er fyldt med pus. Din læge kan beslutte at stoppe din behandling med infliximab.
De mest almindelige bivirkninger af infliximab inkluderer:
- luftvejsinfektioner såsom bihule infektioner og ondt i halsen
- hovedpine
- hosteing
- mavesmerter
Infusionsreaktioner kan ske op til 2 timer efter din infusion af infliximab. Symptomer på infusionsreaktioner kan omfatte:
- feber
- kulderystelser
- brystsmerter
- Lavt blodtryk or high blood pressure
- åndenød
- udslæt
- kløe
Børn, der modtog infliximab i undersøgelser for Crohns sygdom, viste nogle forskelle i bivirkninger sammenlignet med voksne, der modtog infliximab for Crohns sygdom. Bivirkningerne, der skete mere hos børn, var: anæmi (lavrøde blodlegemer) leukopeni (lave hvide blodlegemer) med rødme eller rødme) virale infektioner neutropeni (lave neutrofiler de hvide blodlegemer, der bekæmper infektion) knogler brudbakterieinfektion og allergiske reaktioner af åndedrætskærmen. Blandt patienter, der modtog infliximab til ulcerøs colitis i kliniske studier, havde flere børn infektioner sammenlignet med voksne.
Fortæl din læge om enhver bivirkning, der generer dig eller ikke forsvinder.
Dette er ikke alle bivirkninger med infliximab. Spørg din læge eller apotek for mere information.
Ring til din læge for medicinsk rådgivning om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800FDA-1088.
Generel information om infliximab
Medicin er undertiden ordineret til andre formål end dem, der er anført i en medicinguide. Du kan bede din læge eller farmaceut om information om infliximab, der er skrevet til sundhedsfagfolk.
For mere information ring 1-800-Janssen (1-800-526-7736).
Hvad er ingredienserne i infliximab?
Den aktive ingrediens er infliximab.
De inaktive ingredienser i infliximab inkluderer: dibasisk natriumphosphatdihydrat monobasisk natriumphosphat monohydrat polysorbat 80 og saccharose. Ingen konserveringsmidler er til stede.
Denne medicinguide er godkendt af U.S. Food and Drug Administration.