Crofab
Oplysningerne På Webstedet Er Ikke Medicinsk Rådgivning. Vi Sælger Ikke Noget. Nøjagtigheden Af Oversættelsen Er Ikke Garanteret. Ansvarsfraskrivelse
Resume af lægemiddeloversigt
Hvad er Crofab?
Crofab [Crotalidae Polyvalent Immune Fab) (ivine)] er et antiveninprodukt, der bruges som et anti-venom til bid fra visse slanger (f.eks. Rattlesnakes Cottonmouths/Water Moccasins Copperheads).
Hvad er bivirkninger af CrofAb?
Crofab
- elveblest
- Besvær
- Hævelse af dine ansigtslæber tunge eller hals
- kløe
- rødme
- hvæsende
- problemer med at trække vejret
- Lightheadedness
- feber
- kvalme
- Lændesmerter
- Let blå mærker
- Usædvanlig blødning (næseblødning blødende tandkød blødning fra en skade)
- lilla eller røde præciser på din hud
- hævede kirtler
- udslæt eller kløe
- ledssmerter
- generel syg følelse
- tung menstruationsblødning og
- udslæt
Få medicinsk hjælp med det samme, hvis du har nogen af de symptomer, der er anført ovenfor.
Almindelige bivirkninger af CrofAb inkluderer:
- elveblest
- udslæt
- kløe and
- kvalme.
Mindre almindelige bivirkninger af CrofAb inkluderer:
- Problemer med blod koagulation
- Rygsmerter
- brystsmerter
- kulderystelser
- Lavt blodtryk
- astma
- hoste
- Tab af appetit
- Muskelsmerter
- følelsesløshed og prikken og
- nervøsitet.
Søg medicinsk behandling eller ring 911 på én gang, hvis du har følgende alvorlige bivirkninger:
- Alvorlige øjensymptomer såsom pludseligt synstab sløret synet tunnel vision øje smerter eller hævelse eller at se haloer omkring lys;
- Alvorlige hjertesymptomer såsom hurtig uregelmæssige eller bankende hjerteslag; flagrende i brystet; åndenød; og pludselig svimmelhed letthed eller udlevering;
- Alvorlig hovedpine forvirring sløret talearm eller ben svaghed problemer med at gå tab af koordination føles ustabil meget stive muskler høj feber voldsom sved eller rysten.
Dette dokument indeholder ikke alle mulige bivirkninger, og andre kan forekomme. Kontakt din læge for yderligere oplysninger om bivirkninger.
Dosering til crofab
Administration af Antivenin skal indledes så hurtigt som muligt efter crotalid slakebite hos patienter, der udvikler tegn på progressiv envenomation (f.eks. Forværring af lokal skade Koagulation abnormitet eller systemiske tegn på envenomation). Den anbefalede indledende dosis af CrofAb er 4 til 6 hætteglas.
Hvilke stoffer stoffer eller kosttilskud interagerer med crofab?
CrofAb kan interagere med andre lægemidler. Fortæl din læge alle medicin og kosttilskud, du bruger.
Crofab under graviditet eller amning
Under graviditet skal Crofab kun bruges, hvis det er foreskrevet. Det er ukendt, om dette stof passerer til modermælk. Kontakt din læge inden amning.
Yderligere oplysninger
Vores Crofab [Crotalidae Polyvalent Immune Fab) (EVine)] Bivirkninger Drug Center giver et omfattende overblik over tilgængelige lægemiddelinformation om de potentielle bivirkninger, når du tager denne medicin.
FDA -lægemiddelinformation
- Lægemiddelbeskrivelse
- Indikationer
- Bivirkninger
- Advarsler
- Overdosis
- Klinisk farmakologi
- Medicin vejledning
Beskrivelse til CrofAb
Crofab [Crotalidae Polyvalent Immun Fab (Ovid)] er en steril ikke -pyrogen oprenset lyofiliseret forberedelse af ovine fab (monovalent) immunoglobulinfragmenter opnået fra blodet af sunde fåreklokke immuniseret med en af følgende nordamerikanske slange venoms: crotalus atrox (Western DiamondBack Rattlesnake) crotal Diamondback Rattlesnake) Crotalus scutulatus (Mojave Rattlesnake) og Agkistrodon Piscivorus (Cottonmouth eller Water Moccasin). For at opnå det endelige antiveninprodukt blandes de fire forskellige monospecifikke antiveniner. Hver monospecifik antivenin fremstilles ved at fraktionere immunoglobulinet fra ovine -serum, der fordøjer det med papain og isolerer den giftspecifikke FAB -fragmenter på ionudveksling og affinitetskromatografikolonner.
CrofAb er standardiseret efter dens evne til at neutralisere den dødelige virkning af hver af de fire venomimmunogener efter intravenøs injektion hos mus. Produktets styrke varierer fra batch til batch; dog et minimum antal mus LD50 Neutraliserende enheder mod hver af de fire gift er inkluderet i hvert hætteglas med slutprodukt som vist i tabel 3.
Tabel 3 Minimum mus LD50 Neutraliserende enheder1 For hver giftkomponent
| Venom | Minimum styrke pr. Hætteglas med CrofAb2 |
| Crotalus Atrox | ≥ 1270 |
| Adamanus Adamanteure | ≥ 420 |
| Crotalus scutulatus | ≥ 5570 |
| Agkistrodon Piscivorus | ≥ 780 |
| 1En neutraliserende enhed bestemmes som mængden af de blandede monospecifikke FAB -proteiner, der er nødvendige for at neutralisere en LD50 af hver af de fire gift50 er mængden af gift, der ville være dødbringende hos 50% af musene. 2Fra 2008 er styrkeassayet optimeret til en ny stamme af mus, som har resulteret i ændringer i den minimale mus LD50 Neutraliserende enheder. Disse ændringer afspejler ikke nogen ændring i produktstyrken, men kun en anden biologisk respons fra |
Hvert hætteglas med crofAb indeholder op til 1 g total protein- og natriumphosphatbuffer bestående af dibasisk natriumphosphat USP og natriumchlorid USP. Thimerosal bruges som konserveringsmiddel i fremstillingsprocessen, og som sådan overføres kviksølv til det endelige produkt med et beløb, der ikke er større end 30 mcg pr. Hætteglas, hvilket udgør højst 0,6 mg kviksølv pr. Dosis (baseret på den maksimale dosis af 18 hætteglas anvendt i kliniske undersøgelser af crofAb). Produktet er beregnet til intravenøs administration efter rekonstitution med 18 ml 0,9% saltvand.
Anvendelser til CrofAb
Crofab er indikeret til håndtering af voksne og pædiatriske patienter med nordamerikansk crotalid envenomation (se tabel 5 i Kliniske studier til definitioner). Udtrykket crotalid bruges til at beskrive Crotalinae -underfamilien (tidligere kendt som Crotalidae) af giftige slanger, der inkluderer rattlesnakes kobberhoveder og Cottonmouths/Water Moccasins.
Dosering til crofab
Kun til intravenøs brug
Dosering
- Administrer CrofAb så hurtigt som muligt hos patienter, der udvikler tegn på envenomation (f.eks. Sektioner eller underafsnit udeladt fra de fulde ordinerende oplysninger er ikke anført. Lokal skadeskoagulations abnormalitet eller systemiske tegn på envenomation) for at forhindre klinisk forringelse. CrofAB blev vist i kliniske studier som effektiv, når det gives inden for 6 timer efter Snakebite.
- Krav til antivenin -dosering er betinget af en individuel patients respons. Baseret på klinisk erfaring med CrofAb er den anbefalede indledende dosis 4 til 6 hætteglas; Imidlertid kan startdosis variere fra mindst 4 hætteglas til højst 12 hætteglas baseret på klinisk vurdering og sværhedsgrad af envenomation [3].
- Patienten skal observeres i op til 1 time efter afslutningen af denne første dosis for at bestemme, om den første kontrol af envenomationen er opnået. Den oprindelige kontrol opnås, når lokale tegn på envenomation arresteres (førende kant af lokal skade, der ikke skrider frem) systemiske symptomer løses, og koagulationsparametre har normaliseret eller er tendens til normal.
- Hvis den første kontrol ikke opnås ved den første dosis, skal en yderligere dosis på 4 til 6 hætteglas gentages, indtil den første kontrol af envenomationssyndromet er opnået.
- Efter den indledende kontrol er blevet etableret yderligere 2-doser af crofAb hver 6. time i op til 18 timer (3 doser) anbefales. Optimal dosering efter den 18-timers planlagte dosis af CrofAb er ikke bestemt. Yderligere 2-doser kan administreres som det, der anses for nødvendigt af den behandlende læge baseret på patientens kliniske forløb.
- Yderligere patientpleje (støttende og supplerende terapi) : Infusionsreaktioner, såsom feber -rygsmerter, hvæsende og kvalme kan være relateret til infusionshastigheden og kan kontrolleres ved at reducere indgivelseshastigheden for opløsningen [12]. Giftkontrolcentre er en nyttig ressource til individuel behandlingsrådgivning.
Forberedelse og administration
- Parenterale lægemiddelprodukter skal inspiceres visuelt for partikler og misfarvning inden administration hver gang løsning og containertilladelse.
- Hvert hætteglas med CrofAb skal rekonstitueres med 18 ml 0,9% saltvand (fortyndingsmiddel ikke inkluderet) og blandes med kontinuerlig manuel inversion, indtil intet fast materiale er synligt i hætteglasset. Ryst ikke. Indholdet af alle de rekonstituerede hætteglas bør fortyndes yderligere til et samlet volumen på 250 ml med 0,9% natriumchlorid USP og blandes med forsigtigt hvirvlende.
- Den indledende dosis af crofAb fortyndet i 250 ml saltvand skal infunderes intravenøst over 60 minutter. Imidlertid bør infusionen gå langsomt i løbet af de første 10 minutter ved en 25- 50 ml/times hastighed med omhyggelig observation for enhver allergisk reaktion. Hvis der ikke forekommer nogen sådan reaktion, kan infusionshastigheden øges til den fulde 250 ml/timehastighed, indtil den er færdig. Luk patientovervågning er nødvendig.
- Det rekonstituerede og fortyndede produkt skal bruges inden for 4 timer.
Hvor leveret
Dosering Forms And Strengths
CrofAb leveres som en steril ikke -pyrogen oprenset lyofiliseret pulver. Hvert hætteglas indeholder op til 1 gram total protein maksimalt 0,03 mg kviksølv og ikke mindre end det angivne antal mus LD50 Neutraliserende enheder*:
| Slangearter, der bruges til antivenin -komponent | Minimum mus LD50 Enheder pr. Hætteglas |
| C. Atrox (Western Diamondback Rattlesnake) | 1270 |
| C. Adamanteus (Eastern Diamondback Rattlesnake) | 420 |
| C. scutulatus (Mojave Rattlesnake) | 5570 |
| A. Piscivorus (Cottonmouth eller Water Moccasin) | 780 |
| *Fra 2008 er styrkeassayet optimeret til en ny stamme af mus, som har resulteret i ændringer i den minimale mus LD50 Neutraliserende enheder. Disse ændringer afspejler ikke nogen ændring i produktstyrken, men kun en anden biologisk respons fra mouse strain to the venom. |
Opbevaring og håndtering
Crofab leveres som en karton, der indeholder 2 hætteglas med produkt (fortyndingsmiddel ikke inkluderet). Hvert hætteglas med crofab indeholder op til 1 gram lyofiliseret total protein og ikke mindre end det angivne antal mus LD50 Neutraliserende enheder:
| Slangearter, der bruges til antivenin -komponent | Minimum mus LD50 Enheder pr. Hætteglas |
| C. Frygtelig (Western Diamondback Rattlesnake) | 1270 |
| C. Adamanteus (Eastern Diamondback Rattlesnake) | 420 |
| C. Sculatus (Mojave Rattlesnake) | 5570 |
| A. Piscivorus (Cottonmouth eller Water Moccasin) | 780 |
NDC 50633-110-12
- Opbevares ved 2 ° til 8 ° C (36 ° til 46 ° F).
- Frys ikke.
- Brug inden for 4 timer efter rekonstitution.
Referencer
3. LAVONAS EJ RUHA AM BANNER W BEBARTA V BERNSTEIN JN BUSH SP KERNS WP RICHARDSON WH SEIFERT SA TANEN DA CURRY SC DART RC. Unified Treatment Algorithm til styring af Crotaline Snakebite i USA: Resultater af et evidensinformeret konsensusværksted. BMC Emerg Med 3. februar 2011; 11: 2 (https://www.biomedcentral.com/1471-227x/11/2).
12. Kirkpatrick Ch Digibind Study Advisory Panel. Allergiske historier og reaktioner hos patienter behandlet med Digoxin Immun Fab (EVINE) antistof. Am J Emerg Med 1991; 9 (2 Suppl 1): 7 10.
Distribueret af: BTG International Inc. West Conshohocken PA 19428. Revideret: juli 2016
Bivirkninger til crofab
Bivirkninger, der opstod i ≥5% af forsøgspersoner, var urticaria udslæt kvalme krypuritus og rygsmerter.
Kliniske forsøg oplever
Fordi kliniske forsøg udføres under vidt forskellige tilstande, kan der ikke sammenlignes bivirkninger, der er observeret i de kliniske forsøg med et lægemiddel, ikke direkte med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de hastigheder, der er observeret i klinisk praksis.
- De mest almindelige bivirkninger rapporteret i de kliniske undersøgelser var urticaria udslæt og kvalme. Bivirkninger, der involverede huden og vedhæng (primært udslæt urticaria og kløe) blev rapporteret hos 12 af de 42 patienter (tabel 1).
- Af de 19 patienter, der oplevede bivirkninger, oplevede 3 patienter alvorlige eller alvorlige bivirkninger.
- Den 1 patient, der oplevede en alvorlig bivirkning, havde en tilbagevendende koagulopati på grund af envenomation, som krævede re-hospitalisering og yderligere antivenin-administration. Denne patient gjorde til sidst en fuldstændig bedring.
- De andre 2 havde alvorlige bivirkninger, der bestod af 1 patient, der udviklede alvorlig urticaria efter behandling og 1 patient, der udviklede et alvorligt udslæt og kløe flere dage efter behandling. Begge patienter kom sig efter behandling med antihistaminer og prednison.
- En patient afbrød CrofAb -terapi på grund af en allergisk reaktion.
Tabel 1 Forekomst af kliniske bivirkninger i undersøgelser af CrofAb efter kropssystem
| Advers E -reaktion | n = 42* Antal begivenheder |
| Krop som helhed | |
| Rygsmerter | 2 |
| Allergisk reaktion† | 1 |
| Serumsyge | 1 |
| Serumsyge | |
| Urticaria | 7 |
| Udslæt | 3 |
| Kløe | 2 |
| Subkutan knude | 1 |
| Åndedrætssystem | |
| Hoste | 1 |
| Fordøjelsessystem | |
| Kvalme | 3 |
| Anorexia | 1 |
| Hæmatologisk/lymfatisk | |
| Koaguleringsforstyrrelse | 1 |
| Ecchymosis | 1 |
| Muskuloskeletal | |
| Myalgi | 1 |
| Nervesystem | |
| Nervøsitet | 1 |
| *Af de 42 patienter, der modtog CrofAB i de kliniske studier 19, oplevede en bivirkning. I alt 26 bivirkninger blev oplevet af disse 19 patienter. †Allergisk reaktion consisted of urticaria dyspnea and hvæsende in 1 patient. |
Hos de 42 patienter, der blev behandlet med CrofAB for minimale eller moderate crotalid -envenomationer, var der 7 begivenheder klassificeret som tidlige serumreaktioner og 5 begivenheder klassificeret som sene serumreaktioner, og ingen var alvorlige (tabel 2). I de kliniske studier bestod serumreaktioner hovedsageligt af urticaria og udslæt, og alle patienter blev udvundet uden følger.
Tabel 2 Forekomst af tidlige og sene serumreaktioner (reaktioner, der er ocieret med crofab -infusion)
| n = 42* Antal begivenheder | |
| Tidlige serumreaktioner | |
| Urticaria | 5 |
| Hoste | 1 |
| Allergisk reaktion** | 1 |
| Sene serumreaktioner | |
| Udslæt | 2 |
| Kløe | 1 |
| Urticaria | 1 |
| Serumsyge† | 1 |
| *6 af 42 patienter oplevede en bivirkning, der var forbundet med en tidlig serumreaktion, og 4 oplevede en bivirkning, der var forbundet med en sen serumreaktion. To yderligere patienter blev betragtet som en sen serumreaktion af efterforskeren, skønt der ikke blev rapporteret om nogen tilknyttet bivirkning. ** Allergisk reaktion bestod af urticaria dyspnø og vejrtrækning hos 1 patient. †Serumsyge consisted of severe udslæt and pruritus in 1 patient. |
Yderligere offentliggjorte kliniske studier oplever
Fra en litteraturgennemgang af ni publikationer om CROFAB indeholdende patienteksponeringsdata 15 af 313 (4,8%) patienter, der modtog CROFAB, oplevede akutte overfølsomhedsreaktioner.
De mest almindelige tegn og symptomer, der var forbundet med disse reaktioner, var udslæt (10 patienter) og vejrtrækning (3 patienter). De fleste reaktioner var milde opløst efter antihistaminbehandling og krævede ikke seponering af antivenombehandling. Ingen patient udviklede en livstruende overfølsomhedsreaktion krævet, at intubation led varig dårlig virkning eller døde som et resultat af CrofAb-administration.
Opfølgningsdata (mindst seks dage efter behandling) var tilgængelige hos 94 af de 313 patienter og forsinkede overfølsomhedsreaktioner blev rapporteret i 10 tilfælde. De mest almindelige tegn og symptomer på forsinket overfølsomhed var udslæt (9 patienter) og feber (3 patienter). De fleste var milde og behandlede med antihistaminer og steroider.
Oplevelse af postmarketing
Følgende yderligere bivirkninger er blevet identificeret under brugen efter godkendelse af CrofAb. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt at pålideligt estimere deres frekvens eller etablere et årsagsforhold til produkteksponering:
- Forsinket allergisk reaktion manifesteret ved feber -kløe og/eller udslæt
- Forsinket eller tilbagevendende koagulopati eller thrombocytopeni
- Manglende opnåelse af første kontrol
- Tilbagevendende hævelse ildfast til behandling
- Thrombocytopenia ildfast til behandling
- Langvarig indlæggelse
- Blødende
- Rysten
- Behandlingssvigt resulterede i døden
En retrospektiv undersøgelse af data indsamlet af Rocky Mountain Poison and Drug Center for Postmarketing brug af Crofab blev udført (se Kliniske studier Postmarketing -undersøgelser ).
- Der blev rapporteret i alt 36 øjeblikkelige bivirkninger rapporteret i 6,1% (15/247) af patienter i den eftermarkedsførende retrospektive undersøgelse inklusive en patient i den alvorligt envenomerede gruppe (3,6% N = 28) og 13 patienter i den milde/moderate sværhedsgruppe (7,2% n = 181) (ikke signifikant forskellige rater).
- Der var 11 øjeblikkelige alvorlige bivirkninger relateret til CrofAB -administration rapporteret hos fire patienter. Begivenhederne omfattede to episoder hver af hypotension og tunge hævelse og en episode hver af brystet ubehag angioødem bronchospasme hvæsende trachealødemdyspnø og hævelse i læbe.
- Der var 22 øjeblikkelige ikke-alvorlige bivirkninger relateret til CrofAB-administration rapporteret hos 12 patienter. Begivenhederne omfattede fire episoder hver af udslæt og kløe tre episoder af urticaria og en episode hver af takykardi -tachypnea erythema hævelse hyperhidrosis svimmelhed hovedpine muskuloskeletal brystsmerter kulderystelser føles kold og nervøsitet.
- Forsinkede overfølsomhedsreaktioner blev rapporteret for to patienter. Hos en patient forekom symptomerne 6 dage efter dosering var ikke alvorlige og beskrev som nældefeber kløe og epigastrisk tryk. I de anden patient blev symptomer ikke beskrevet i de medicinske poster og blev derfor ikke fanget i denne undersøgelse.
- Tilbagevendende koagulopati udviklet hos 5 alvorligt envenomerede patienter og hos 6 milde/moderate envenomerede patienter. Derudover oplevede 7 milde/moderate patienter forsinket koagulopati. En alvorligt envenomeret patient med tilbagevendende koagulopati oplevede medicinsk signifikant blødning.
Lægemiddelinteraktioner for CrofAb
Ingen oplysninger leveret
Advarsler for Crofab
Inkluderet som en del af 'FORHOLDSREGLER' Afsnit
Forholdsregler for CrofAb
Koagulopati
Koagulopati is a complication noted in many victims of viper envenomation that arises due to the ability of the snake venom to interfere with the blood Koagulation cascade [5 9 10] and is seen more frequently in severely envenomated patients. In clinical trials with CROFAB recurrent coagulopathy (the return of a Koagulation abnormality after it has been successfully treated with antivenin) characterized by decreased fibrinogen decreased platelets and elevated prothrombin time occurred in approximately half of patients studied. The clinical significance of these recurrent abnormalities is not known. Recurrent Koagulation abnormalities were observed only in patients who experienced Koagulation abnormalities during their initial hospitalization although coagulopathy can initially appear at any time before during or after treatment. Optimal dosing to completely prevent recurrent coagulopathy has not been determined. Because CROFAB has a shorter persistence in the blood than crotalid venoms that can leak from depot sites over a prolonged period of time repeat dosing to prevent or treat such recurrence may be necessary (see Dosering og administration ).
Tilbagevendende koagulopati kan fortsætte i 1 til 2 uger eller mere. Patienter, der oplever koagulopati på grund af Snakebite under indlæggelse til indledende behandling, skal overvåges for tegn og symptomer på tilbagevendende koagulopati i op til 1 uge eller længere efter lægens skøn. I denne periode skal lægen nøje vurdere behovet for genbehandling med CrofAb og anvendelse af enhver type antikoagulant- eller anti-platelet-lægemiddel.
Fordi slange -envenomation kan forårsage abnormiteter i koagulation, skal de følgende tilstande, der også er forbundet med koagulationsdefekter, overvejes: kræftkollagensygdom kongestiv hjertesvigt diarré forhøjet temperatur Hepatiske lidelser Hypertyroidisme Dårlig ernæringstilstand steatorrhea vitamin Kmangel.
Overfølsomhedsreaktioner
Alvorlige overfølsomhedsreaktioner kan forekomme med CrofAb. I tilfælde af akutte overfølsomhedsreaktioner, herunder anafylaksi og anafylactoidreaktioner, afbryder infusion og instituttet afsat akut behandling.
Crofab indeholder oprensede immunoglobulinfragmenter fra fåren af får, der er blevet immuniseret med slangegift (se BESKRIVELSE ). Injection of heterologous animal proteins can cause severe acute and delayed hypersensitivity reactions (late serum reaction or serum sickness) and a possible febrile response to immune complexes formed by animal antibodies and neutralized venom components [11].
Hjælper Benadryl med sinuspres
Papain bruges til at spalte antistoffer i fragmenter under behandlingen af crofAb og sporingsmængder af papain eller inaktiverede papainrester kan være til stede. Patienter, der er allergisk over for papain chymopapain Andre papaya -ekstrakter eller ananasenzym Bromelain kan også have en allergisk reaktion på crofab. Nogle støvmideallergener og nogle latexallergener deler antigene strukturer med papain og patienter med disse allergier kan være allergiske over for papain [7 8].
Følgende forholdsregler skal bruges til at håndtere overfølsomhedsreaktioner:
- Emergency medicinsk behandling (f.eks. Epinephrin intravenøse antihistaminer og/eller albuterol) bør være let tilgængelig.
- Overvåg omhyggeligt patienter for tegn og symptomer på en akut allergisk reaktion (f.eks. Urticaria kløe erythema angioødem bronchospasme med vejrtrækning eller hoste stridor laryngeal ødem hypotension tachycardia).
- Opfølgning af alle patienter for tegn og symptomer på forsinkede allergiske reaktioner eller serumsyge (f.eks. Udslæt feber myalgia arthralgia).
Patienter, der modtager et behandlingsforløb med et fremmed protein, såsom CrofAB, kan blive følsomme over for det. Derfor bør der anvendes forsigtighed, når man administrerer et gentagne behandlingsforløb med CrofAB til en efterfølgende envenomationsepisode.
Hudtest er ikke blevet anvendt i kliniske forsøg med crofAb og er ikke påkrævet.
Kviksølvtoksicitet
Det endelige produkt indeholder op til 30 mcg eller ca. 0,03 mg kviksølv pr. Hætteglas, hvilket udgør højst 0,6 mg kviksølv pr. Dosis (baseret på den maksimale dosis af 18 hætteglas, der er undersøgt i kliniske forsøg med crofab). Selvom der ikke er nogen definitive data om toksiciteten af ethylkviksølvlitteratur antyder, at information relateret til methylkviksølvtoksiciteter kan være anvendelige.
Ikke -klinisk toksikologi
Ingen oplysninger leveret
Brug i specifikke populationer
Graviditet
Risikooversigt
Dyreproduktionsundersøgelser er ikke blevet udført med CrofAb. Det vides heller ikke, om Crofab kan forårsage føtalskade, når den administreres til en gravid kvinde eller kan påvirke reproduktionskapaciteten. Crofab bør kun gives til en gravid kvinde, hvis det er klart nødvendigt. I den amerikanske generelle befolkning er den estimerede baggrundsrisiko for større fødselsdefekter og spontanabort i klinisk anerkendte graviditeter henholdsvis 2-4% og 15-20%.
Kliniske overvejelser
Crofab indeholder kviksølv i form af ethylkviksølv fra thimerosal (se Advarsler og forholdsregler Kviksølv ). Although there are limited toxicology data on ethyl mercury high dose and acute exposures to methyl mercury have been associated with neurological and renal toxicities. Developing fetuses and very young children are most susceptible and therefore at greater risk.
Amning
Risikooversigt
Det vides ikke, om Crofab udskilles i human modermælk. Fordi mange lægemidler udskilles i menneskelig mælkens forsigtighed bør udøves, når Crofab administreres til en sygeplejekvinde.
Pædiatrisk brug
Specifikke undersøgelser hos pædiatriske patienter er ikke blevet udført. Begrænset klinisk erfaring har ikke vist, at der skal foretages en doseringsjustering for alder.
Crofab indeholder kviksølv i form af ethylkviksølv fra thimerosal (se Advarsler og forholdsregler Kviksølv ). Although there are limited toxicology data on ethyl mercury high dose and acute exposures to methyl mercury have been associated with neurological and renal toxicities. Developing fetuses and very young children are most susceptible and therefore at greater risk.
Geriatrisk brug
Specifikke undersøgelser hos ældre patienter er ikke blevet udført.
Referencer
5. Lyons WJ. Dybt thrombocytopeni forbundet med Crotalus Ruber Ruber Envenomation: En klinisk sag. Toxicon 1971; 9: 237 240.
7. Quarre JP Lecomte J Lauwers D Gilbert P Thiriaux J. Allergi til Latex og Papain. J Allergy Clin Immunol 1995; 95 (4): 922.
8. Baur X Chen Zrozynek P Düser D Raulf Heimsoth M. Cross Reacting IgE -antistoffer, der genkender latexallergener inklusive HEV B 1 såvel som papain. Allergy 1995; 50 (7): 604 609.
9. Furlow TG Brennan 55. Purple efter træ rattlesnake (Crotalus ru) Envenomation. Skin 1985; 35: 234 236.
10. Budzynski Az Pandya Bv Rubin Rn Brizuela BS Soszka T Stewart GJ. Fibrinogenolytisk afibrinogenæmi efter envenomation af Western Diamondback Rattlesnake (Crotalus Atrox). Blod 1984; 63 (1): 1 14.
11. Kojis FG. Serumsyge og anafylaksi. Am J Dis Child 1997; 93 350.
Overdoseringsoplysninger til Crofab
Ingen oplysninger leveret
Kontraindikationer for CrofAb
Crofab bør ikke administreres til patienter med en kendt historie med overfølsomhed over for papaya eller papain, medmindre fordelene opvejer risikoen og passende håndtering for anafylaktiske reaktioner er let tilgængelig.
Klinisk farmakologi for Crofab
Handlingsmekanisme
CrofAb er et giftspecifikt Fab-fragment af immunoglobulin G (IgG), der fungerer ved at binde og neutralisere gift-toksiner, der letter deres omfordeling væk fra målvæv og deres eliminering fra kroppen.
Farmakokinetik
Den farmakokinetiske undersøgelse af CrofAB blev ikke udført tilstrækkeligt. Et begrænset antal prøver blev opsamlet fra tre patienter. Baseret på disse datalestimater af eliminering blev halvdelen af halveringstiden foretaget. Eliminering af halveringstid for Total Fab varierede fra cirka 12 til 23 timer. Disse begrænsede farmakokinetiske estimater af halveringstid forstærkes med data opnået med et analogt ovine FAB-produkt produceret af Prothics Inc. ved hjælp af en lignende produktionsproces. I denne undersøgelse fik 8 raske forsøgspersoner 1 mg intravenøs digoxin efterfulgt af en tilnærmelsesvis ækvimolær neutraliserende dosis på 76 mg digoxin -immunfab (ovine). Total FAB viste sig at have et volumen af fordeling på 0,3 L/kg en systemisk clearance på 32 ml/min (ca. 0,4 ml/min/kg) og en eliminering halveringstid på ca. 15 timer.
Dyretoksikologi og/eller farmakologi
CrofAb var effektiv til at neutralisere giften af 10 klinisk vigtige nordamerikanske crotalid slanger i en murin dødelighedsmodel (se tabel 4) [1]. Derudover antyder foreløbige data fra eksperimenter hos mus ved anvendelse af hele IgG fra fårene immuniseret til crofAb-produktion, at CrofAb kan have antigen tværreaktivitet mod giftene i nogle mellemøstlige og nordafrikanske slanger, men der er ingen kliniske data til rådighed for at bekræfte disse fund.
Tabel 4: Gennemsnitlig ED50 Værdier for crofab hos mus
| Undersøgelsesmål | Målt slutpunkt | Større fund og afsluttende ioner |
| At bestemme crossneutraliseringsevnen hos CrofAb til at beskytte mus mod de dødelige virkninger af gift mod klinisk vigtige arter. | Red50 for hvert gift | (Bemærk: Lavere tal repræsenterer øget styrke mod gifninger, der er anført) |
| Udfordre gift | Red50 (mg antivenin/mg gift) | |
| C. Frygtelig | 3 | |
| C. Adamanteus | 18 | |
| C. Sculatus | 8 | |
| A. Piscivorus | 4 | |
| C. h. atricaudatus | 11 | |
| C. v. Helleri | 6 | |
| C. m. Molossus | 5 | |
| A. c. Contortrix | 8 | |
| S. m. Barbouri | 12 | |
| C. h. Bristly | 6 | |
| Separate grupper af mus blev injiceret med stigende doser af crofAb forblandet med to LD for hvert testet gift. | Baseret på data fra undersøgelser i mus, har CrofAB relativt god tværbeskyttelse mod gift, der ikke er brugt til immunisering af flokke, der blev brugt til at producere det. For C. v. Helleri og C. m. Molossus højere doser kan være påkrævet baseret på historiske data. |
Kliniske studier
Der er ikke udført kliniske undersøgelser, der sammenligner CrofAb med andre antiveniner, derfor kan der ikke foretages nogen sammenligninger mellem CrofAb og andre antiveniner.
To potentielle kliniske forsøg ved hjælp af CrofAb er blevet gennemført. De blev prospektivt definerede åbne etiket multicenterforsøg udført hos ellers sunde patienter 11 år eller ældre, der havde lidt af minimal eller moderat (som defineret i tabel 5) nordamerikansk crotalid envenomation, der viste bevis for progression. Progression blev defineret som forværring af enhver evalueringsparameter, der blev anvendt til klassificering af en envenomation: lokal skadeslaboratorie abnormitet eller symptomer og tegn, der kan henføres til crotalid slange -giftforgiftning. Begge kliniske forsøg udelukkede patienter med kobberhoved envenomation.
Tabel 5: Definition af minimal moderat og svær envenomation i kliniske studier af CrofAb
| Envenomationskategori | Definition |
| Minimal | Hævelse af smerter og ecchymose begrænset til det øjeblikkelige bidsted; Systemiske tegn og symptomer fraværende; Koagulationsparametre Normal uden klinisk bevis for blødning. |
| Moderat | Hævelse af smerter og ecchymose involverer mindre end en fuld ekstremitet, eller hvis bid blev opretholdt på bagagerummet eller nakken, der strækker sig mindre end 50 cm; Systemiske tegn og symptomer Kan være til stede, men ikke livstruende, herunder men ikke begrænset til kvalme opkast oral paræstesi eller usædvanlig smag mild hypotension (systolisk blodtryk> 90 mmHg) mild takykardi (hjerterytme <150) and tachypnea; Koagulationsparametre kan være unormal, men ingen klinisk bevis for blødning til stede. Mindre hæmaturi -tyggegummi og næseblod er tilladt, hvis de ikke betragtes som alvorlige i efterforskerens dom. |
| Alvorlig | Hævelse af smerter og ecchymose involverer mere end en hel ekstremitet eller truer luftvejene; Systemiske tegn og symptomer er markant unormale, herunder alvorlig ændring af mental status alvorlig hypotension alvorlig takykardi tachypnea eller respiratorisk insufficiens; Koagulationsparametre er unormale med alvorlig blødning eller alvorlig trussel om blødning. |
I begge kliniske undersøgelser blev effektiviteten bestemt ved anvendelse af en SnakeBite -sværhedsgrad (SSS) [2] (benævnt effektivitetsresultatet eller ES i disse kliniske studier) og en efterforskers kliniske vurdering (ICA) af effektiviteten. SSS (benævnt ES) er et værktøj, der bruges til at måle sværhedsgraden af envenomation baseret på seks kropskategorier: lokalt sår (f.eks. Smerter hævelse og eckymose) lungehjerdehylderkardiovaskulær gastrointestinal hæmatologiske og nervesystemffekter. En højere score indikerer værre symptomer. I en retrospektiv undersøgelse ved hjælp af medicinske poster af 108 Snakebite -ofre [2] har SSS vist<0.0001) and when the patient's condition was at its worst (r=0.70 p<0.0001). In this study the condition of 87/108 patients worsened during hospitalization. Changes in the physicians' assessment of condition correlated well with changes in SSS. CROFAB was required to prevent an increase in the ES in order to demonstrate efficacy.
ICA var baseret på efterforskerens kliniske vurdering af, om patienten havde en:
- Klinisk respons (forbehandlingsskilte og symptomer på envenomation blev arresteret eller forbedret efter behandling)
- Delvis respons (tegn og symptomer på envenomation forværret, men i en langsommere hastighed end forventet efter behandling)
- Ikke-respons (patientens tilstand blev ikke positivt påvirket af behandlingen).
Sikkerhed blev vurderet ved overvågning for tidlige allergiske begivenheder, såsom anafylaksi og tidlige serumreaktioner under crofab -infusion og sene begivenheder, såsom sene serumreaktioner.
TAB001
I den første kliniske undersøgelse af CrofAB modtog 11 patienter en intravenøs dosis af 4 hætteglas med crofAb over 60 minutter. Yderligere 4-dosis af CrofAb blev administreret efter afslutningen af den første CrofAb-infusion, hvis efterforskeren anses for at være nødvendig. Ved 1-timers vurdering 10 ud af 11 patienter havde ingen ændring eller et fald i deres ES. Ti af 11 patienter blev også vurderet til at have en klinisk respons af ICA. Flere patienter efter den første kliniske respons krævede efterfølgende yderligere hætteglas af CrofAB for at stamme progressive eller tilbagevendende symptomer og tegn. Ingen patient i denne første undersøgelse oplevede en anafylaktisk eller anafylactoid respons eller bevis for en tidlig eller sen serumreaktion som et resultat af administration af crofAb.
TAB002
Baseret på observationer fra den første undersøgelse sammenlignede den anden kliniske undersøgelse af CROFAB to forskellige doseringsplaner. Patienter fik en indledende intravenøs dosis på 6 hætteglas med CrofAB med en mulighed for at trække sig tilbage med yderligere 6 hætteglas, hvis det var nødvendigt for at opnå indledende kontrol af envenomationssyndromet. Den første kontrol blev defineret som komplet arrestation af lokale manifestationer og afkast af koagulationstest og systemiske tegn til normale. Når den første kontrol blev opnået, blev patienter randomiseret til at modtage yderligere CrofAB enten hver 6. time i 18 timer (planlagt gruppe) eller efter behov (PRN -gruppe).
I dette forsøg blev CrofAB administreret sikkert til 31 patienter med minimal eller moderat crotalid envenomation. Alle 31 patienter, der var indskrevet i undersøgelsen, opnåede den første kontrol af deres envenomation med CrofAB, og 30 25 og 26 af de 31 patienter opnåede en klinisk respons baseret på ICA på henholdsvis 1 6 og 12 timer efter den første kontrol. Derudover blev de gennemsnitlige ES signifikant reduceret over patientgrupperne ved 12-timers evalueringstidspunkt (P = 0,05 for den planlagte gruppe; P = 0,05 for PRN-gruppen) (se tabel 6). Der var ingen statistisk signifikant forskel mellem den planlagte gruppe og PRN -gruppen med hensyn til faldet i ES.
Tabel 6: Resumé af patienteffektivitetsresultater for planlagte og PRN -grupper
| Tidsperiode | Planlagt gruppe (n = 15) Effektivitetsresultat* Gennemsnit ± SD | PRN -gruppe (n = 16) Effektivitetsresultat* Gennemsnit ± SD |
| Baseline | 4,0 ± 1,3 | 4,7 ± 2,5 |
| Slut på den første kontrol Antivenin -infusion (er) | 3,2 ± 1,4 | 3,3 ± 1,3 |
| 1 time efter indledende Kontrol opnået | 3,1 ± 1,3 | 3,2 ± 0,9 |
| 6 timer efter indledende Kontrol opnået | 2,6 ± 1,5 | 2,6 ± 1,3 |
| 12 timer efter indledende Kontrol opnået | 2,4 ± 1,1 ** | 2,4 ± 1,2 ** |
| *Ingen ændring eller et fald i effektivitetsresultatet blev betragtet som en indikation af klinisk respons og et tegn på effektivitet. ** For både de planlagte og PRN-grupperne blev forskelle i effektivitetsresultatet ved de fire vurderingstider efter baselinjen statistisk reduceret fra baseline ved Friedmans test (P <0.001). |
I offentliggjorte litteraturregnskaber for klapperslangebid er det blevet bemærket, at et fald i blodplader kan ledsage moderat alvorlig envenomation, som helblodtransfusioner ikke kunne korrigere [3]. Det er observeret, at disse blodpladetællinger er observeret i mange timer, og ofte flere dage efter den giftige bid [3 4 5]. I denne kliniske undersøgelse havde 6 patienter før-doserende blodpladetællinger under 100000/mm3 (Baseline -gennemsnit på 44000/mm3). Of note the platelet counts for all 6 patients increased to normal levels (average 209000/ mm3) 1 time efter indledende kontroldosering med crofAb (se figur 1).
Figur 1 - Graf over blodpladetællinger fra basislinje til 36 timer for patienter med tællinger <100000/mm3 Ved baseline (Study Tab002)
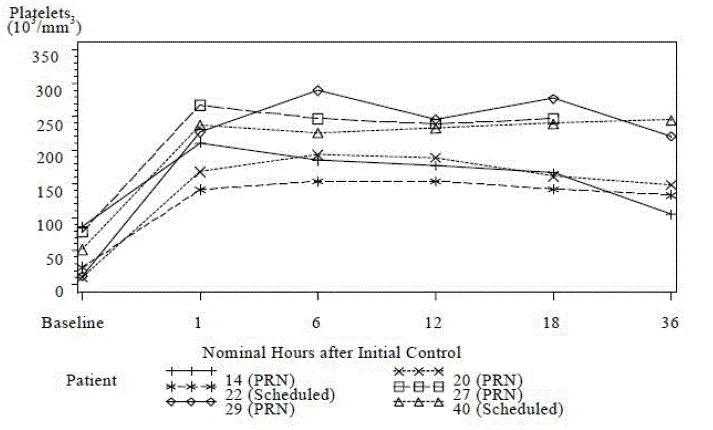 |
Selvom der ikke var nogen signifikant forskel i faldet i ES mellem de to behandlingsgrupper, antyder dataene, at planlagt dosering kan give bedre kontrol af envenomationssymptomer forårsaget af den fortsatte lækage af gift fra depotsteder. Planlagte patienter oplevede en lavere forekomst af koagulations abnormiteter ved opfølgning sammenlignet med PRN -patienter (se tabel 7 og figur 2). Derudover antyder behovet for at administrere yderligere crofAB til patienter i PRN -gruppen efter den første kontrol, at der er et fortsat behov for antivenin til tilstrækkelig behandling.
Tabel 7 Lavere forekomst af gentagelse af koagulopatier ved opfølgning i planlagte og PRN-doseringsgrupper
| Planlagt gruppe (n = 14)* (procent af patienterne med unormale værdier) ∧ | PRN -gruppe (n = 16) (procent af patienterne med unormale værdier) ∧ | |
| Blodplade | 2/14 (14%) ** | 9/16 (56%) ** |
| Fibrinogen | 2/14 (14%) | 7/16 (44%) |
| ∧ Anumbers udtrykkes som procent af patienterne, der havde en opfølgende blodpladetælling, der var mindre end tællingen ved udskrivning på hospitalet eller et fibrinogenniveau mindre end 50% af niveauet ved udskrivning på hospitalet. *Opfølgningsdata, der ikke er tilgængelige for en patient. ** Statistisk signifikant forskel P = 0,04 af Fishers nøjagtige test. |
Figur 2 - Ændring i blodpladetællinger hos individuelle patienter mellem opfølgningsbesøg og decharge
Patienter i de planlagte og PRN -grupper er afbildet separat. Flere patienter i PRN -gruppen viste en reduktion i blodpladetælling efter udskrivning end i den planlagte gruppe. Kun patienter, der viser et reduceret blodpladetælling efter udskrivning, er vist.
 |
 |
Postmarketing -undersøgelser
Efter markedsføringsgodkendelse af CrofAb blev der foretaget en retrospektiv undersøgelse for at vurdere effektiviteten af CrofAb i svær envenomation. Denne undersøgelse var en multicenteret retrospektiv diagramgennemgang af medicinske poster af Snakebite-patienter behandlet med CrofAB og sammenlignede behandling og resultater af alvorlige envenomationer med dem med milde og moderate envenomationer. Den primære effektivitetsvariabel var sværhedsgraden af envenomation som bestemt ved en 7-punkts sværhedsgrad. Patienterne blev klassificeret som at have mild moderat eller svær envenomation baseret på deres score lige inden modtagelse af antivenom. Disse emner med en sværhedsgrad på 5 eller 6 i starten af antivenombehandling var a priori defineret som alvorlige envenomationer; Dem med en score på 3 eller 4 blev defineret som moderate envenomationer, og dem med en score på 1 eller 2 blev defineret som milde envenomationer (se tabel 5). I alt 247 patienter med alle sværhedsgrader blev inkluderet i undersøgelsen. Patienter med nok data til at bestemme baseline -sværhedsgraden blev inkluderet i effektivitetsevalueringen; Dette omfattede en kohort på 209 patienter, hvoraf 28 blev klassificeret som alvorlige.
Forbedring af sværhedsgraden blev observeret hos alle 28 alvorligt envenomerede patienter. Forbedring blev bemærket i hver af de alvorlige giftvirkninger, der blev undersøgt, inklusive lemmersmerter og hævelse af kardiovaskulær respiratorisk gastrointestinal og neurologiske virkning såvel som koagulopati/defibrineringssyndromtrombocytopeni og signifikant/spontan blødning. Den mediandosis af CrofAb, der blev administreret til at kontrollere disse alvorlige gifteffekter, var 9,0 hætteglas (median på 2,0 doser). Den første kontrol af envenomation blev opnået hos 57% (16/28) af alvorligt envenomerede patienter og 87% (158/181) af milde/moderate envenomerede patienter. I begge grupper kunne manglende opnåelse af indledende kontrol oftest tilskrives vedvarende koagulopati og/eller thrombocytopeni, skønt der er rapporteret medicinsk signifikant blødning (forekommer i kun 1 alvorlig patient, der ikke nåede den første kontrol). Alle 12 alvorlige patienter, der ikke nåede den første kontrol, modtog kun en bolusdosis på 4 til 6 hætteglas for at forsøge at opnå initial kontrol af envenomation. Af de 23 milde/moderate tilfælde, der ikke nåede indledende kontrol 19, fulgte ikke anbefalet dosering for antal doser og hætteglas. Hvorvidt den første kontrol kunne have været opnået med større indledende doser af antivenom, kan ikke bestemmes ud fra denne retrospektive undersøgelse. Alle patienter, uanset om de opnåede initial kontrol eller ikke oplevede signifikant forbedring af gifteffekter og nedsat sværhedsgrad efter modtagelse af CrofAB. Blandt de patienter med alvorlig envenomation, der ikke opnåede den første kontrol medianaevidelsesscore, forbedrede sig fra 5,0 (interval: 5,0 - 6,0) før CrofAB -administration til 2,0 (interval: 1,0 - 4,0) ved den sidste laste dosis. Ingen patient i denne analyse havde en sværhedsgrad større end 3,0 på tidspunktet for den endelige kliniske vurdering.
Referencer
1. CONSROE P EGEN NB RUSSELL FE GERRISH K SMITH DC SIDKI A et al. Sammenligning af et nyt ovine -antigenbindende fragment (FAB) antivenin for USA Crotalidae med den kommercielle antivenin til beskyttelse mod gift induceret dødelighed hos mus. J Trop Med Hyg 1995; 53 (5): 507 510.
bivirkninger af for meget MSM
2. Dart RC Hurlbut KM Garcia R Boren J. Validering af en sværhedsgrad til vurdering af crotalid slakebite. Ann Emerg Med 1996; 27 (3): 321 326.
3. LAVONAS EJ RUHA AM BANNER W BEBARTA V BERNSTEIN JN BUSH SP KERNS WP RICHARDSON WH SEIFERT SA TANEN DA CURRY SC DART RC. Unified Treatment Algorithm til styring af Crotaline Snakebite i USA: Resultater af et evidensinformeret konsensusværksted. BMC Emerg Med 3. februar 2011; 11: 2 (https://www.biomedcentral.com/1471-227x/11/2).
4. La Grange RG og Russell Fe. BLODHVARMETSUDUDER I MAN OG RABITER FORTE ALT CROTALUS ENVENOMATION. Proc West Pharmacol Soc 1970; 13: 99-105.
5. Lyons WJ. Dybt thrombocytopeni forbundet med Crotalus Ruber Ruber Envenomation: En klinisk sag. Toxicon 1971; 9: 237 240.
Patientinformation til CrofAb
- Rådgive patienter om at kontakte deres læge med det samme, hvis de oplever usædvanlige blå mærker eller blødning (f.eks. Næseblødning overdreven blødning efter at have børstet tænderne udseendet af blod i afføring eller urin overdreven menstruationsblødning petechiae overdreven blå mærker eller vedvarende oser fra overfladiske skader) efter udledning af hospitalet.
- En sådan blå mærker eller blødning kan forekomme i op til 1 uge eller længere efter den første behandling.
- Rådgiv patienter om at kontakte deres læge med det samme, hvis de oplever tegn og symptomer på forsinkede allergiske reaktioner eller serumsyge (f.eks. Udslæt kløeuritus urticaria) efter udskrivning på hospitalet.












