Venofer
Oplysningerne På Webstedet Er Ikke Medicinsk Rådgivning. Vi Sælger Ikke Noget. Nøjagtigheden Af Oversættelsen Er Ikke Garanteret. Ansvarsfraskrivelse
Resume af lægemiddeloversigt
Hvad er Venofer?
Venofer (Iron Sucrose) -injektion er et jernudskiftningsprodukt, der bruges til behandling af jernmangelanæmi hos mennesker med nyresygdom. Venofer gives normalt med en anden medicin til at fremme væksten af røde blodlegemer (såsom Aranesp Epogen eller Procrit ).
Hvad er bivirkninger af venofer?
Venofer
- Problemer med din dialyse Venadgangspunkt
- brystsmerter
- Alvorlig hovedpine
- sløret vision
- dunkende i din hals eller ører
- Lightheadedness
- smerte eller hævelse
- oppustethed
- kvalme
- opkast
- Tab af appetit
- diarré og
- feber
Få medicinsk hjælp med det samme, hvis du har nogen af de symptomer, der er anført ovenfor.
Almindelige bivirkninger af venofer inkluderer:
- Muskelkramper
- kvalme
- opkast
- mavesmerter
- mærkelig smag i munden eller nedsat følelse af smag
- diarre
- forstoppelse
- hovedpine
- hoste
- ondt i halsen
- sinus smerte
- trængsel
- Rygsmerter
- ledssmerter
- svimmelhed
- svaghed
- træt følelse
- angst
- øresmerter
- hævelse af armene/benene eller
- reaktioner på injektionsstedet (smerter hævelse brændende irritation eller rødme).
Fortæl din læge, hvis du oplever alvorlige bivirkninger af Venofer, inklusive:
- mavesmerter
- brystsmerter
- Uregelmæssig hjerteslag (arytmier)
- Tryk i brystet
- Alvorlig hovedpine og sløret vision ( hypertension ) eller
- Problemer med din dialyse access site (graft).
Søg medicinsk behandling eller ring 911 på én gang, hvis du har følgende alvorlige bivirkninger:
- Alvorlige øjensymptomer såsom pludseligt synstab sløret synet tunnel vision øje smerter eller hævelse eller at se haloer omkring lys;
- Alvorlige hjertesymptomer såsom hurtig uregelmæssige eller bankende hjerteslag; flagrende i brystet; åndenød; og pludselig svimmelhed letthed eller udlevering;
- Alvorlig hovedpine forvirring sløret tale arm eller ben svaghed problemer med at gå tab af koordination føles ustabil meget stive muskler høj feber voldsom sved eller rysten.
Dette dokument indeholder ikke alle mulige bivirkninger, og andre kan forekomme. Kontakt din læge for yderligere oplysninger om bivirkninger.
Dosering til venofer?
Venofer administreres kun intravenøst ved langsom injektion eller ved infusion. Dosis bestemmes af, om patienten er i dialyse, og hvilken type dialyse.
Hvilke stoffer stoffer eller kosttilskud interagerer med Venofer?
Venofer kan interagere med jerntilskud eller andre jernbaserede orale medikamenter, såsom jernholdig fumarat jernholdigt glukonat og jernsulfat og andre. Fortæl din læge alle medicin og kosttilskud, du bruger.
Venofer under graviditet og amning
Venofer skal kun bruges, når det er ordineret under graviditet. Det vides ikke, om dette stof passerer til modermælk. Kontakt din læge inden amning.
Yderligere oplysninger
Vores Venofer (Iron Sucrose) bivirkninger Drug Center giver et omfattende overblik over tilgængelige lægemiddelinformation om de potentielle bivirkninger, når du tager denne medicin.
FDA -lægemiddelinformation
- Lægemiddelbeskrivelse
- Indikationer
- Bivirkninger
- Advarsler
- Overdosis
- Klinisk farmakologi
- Medicin vejledning
Beskrivelse for venofer
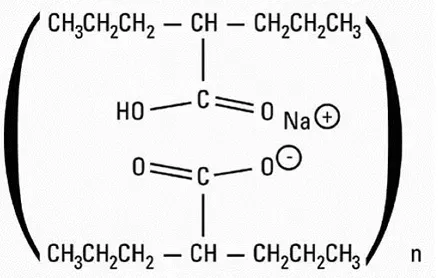
Venofer (Iron Sucrose-injektion USP) Et jernudskiftningsprodukt er et brunt sterilt vandigt kompleks af polynukleært jern (III) -hydroxid i saccharose til intravenøs brug. Iron Sucrose -injektion har en molekylvægt på ca. 34000 til 60000 daltoner og en foreslået strukturel formel:
[Na2Fe5O8(OH) • 3 (h2O)] n • m (c12H22O11) Hvor: N er graden af jernpolymerisation, og M er antallet af saccharose-molekyler, der er forbundet med jern (III) -hydroxid.
Hver ML indeholder 20 mg elementært jern som jernsaccharose i vand til injektion. Venofer fås i 10 ml enkeltdosis hætteglas (200 mg elementært jern pr. 10 ml) 5 ml enkeltdosis hætteglas (100 mg elementært jern pr. 5 ml) og 2,5 ml enkeltdosis hætteglas (50 mg elementært jern pr. 2,5 ml). Lægemiddelproduktet indeholder ca. 30% saccharose W/V (300 mg/ml) og har en pH på 10,5 til 11,1. Produktet indeholder ingen konserveringsmidler. Injektionens osmolaritet er 1250 mosmol/l.
Anvendelser til venofer
Venofer er indikeret til behandling af jernmangelanæmi (IDA) hos patienter med kronisk nyresygdom (CKD).
Dosering til venofer
Venofer må kun administreres intravenøst enten ved langsom injektion eller ved infusion. Doseringen af venofer udtrykkes i Mg elementært jern. Hver mlcontains 20 mg elementært jern.
Administrationstilstand
Administrer venofer kun intravenøst ved langsom injektion eller ved infusion. Doseringen af venofer udtrykkes i Mg elementært jern. Hver ML indeholder 20 mg af elementalt jern.
Voksne patienter med hæmodialyseafhængig-krygronisk nyresygdom (HDD-CKD)
Administrer venofer 100 mg ufortyndet som en langsom intravenøs injektion over 2 til 5 minutter eller som en infusion på 100 mg fortyndet i maksimalt 100 ml 0,9%NaCI over en periode på mindst 15 minutter pr. På hinanden følgende hæmodialyse -session [se Hvor leveret ]
Administrer Venofer tidligt under dialysesessionen (generelt inden for den første time). Det sædvanlige samlede behandlingsforløb for venofer er 1000 mg. Venofer -behandling kan gentages, hvis jernmangel.
Voksne patienter med ikke-dialyseafhængig-kronisk nyresygdom (NDD-CKD)
Administrer venofer 200 mg ufortyndet som en langsom intravenøs injektion over 2 til 5 minutter eller som en infusion på 200 mg i maksimalt 100 ml 0,9% NaCl -overa periode på 15 minutter. Administrer ved 5 forskellige lejligheder over en 14 -dages periode. Der er begrænset erfaring med administration af en infusion af 500 mg venofer fortyndet i maksimalt 250 ml 0,9% NaCl over en periode på 3,5 til 4 timer på dag 1 og dag 14 [se Hvor leveret ] Venofer -behandling kan gentages, hvis jernmangel gentages.
Voksne patienter med peritoneal dialyseafhængig-kronisk nyresygdom (PDD-CKD)
Administrer venofer i 3 opdelte doser givet ved langsom intravenøs infusion inden for en 28 dages periode: 2 infusioner hver på 300 mg over 1,5 timer 14 dage Apart efter en 400 mg infusion over 2,5 timer 14 dage senere. Fortyndet venofer i højst 250 ml 0,9% NaCl [se Hvor leveret ] Venofer -behandling kan gentages, hvis jernmangel gentages.
Pædiatriske patienter (2 år gammel og ældre) med HDD-CKD til jernvedligeholdelsesbehandling
Til jernvedligeholdelsesbehandling: Administrer venofer i en dosis på 0,5 mg/kg, der ikke overstiger 100 mg pr. Dosis hver anden uge i 12 uger, der er givet ufortyndet med langsom intravenøs injektion over 5 til 60 minutter eller fortyndet i 0,9% NaCI i en koncentration på 1 til 2 mg/ml og administreret over 5 til 60 minutter. Fortynd ikke til koncentrationer under 1 mg/ml [se Hvor leveret ) Venofer -behandling kan gentages om nødvendigt.
Doseringen til jernudskiftningsbehandling hos pædiatriske patienter med HDD-CKD er ikke blevet fastlagt.
Pædiatriske patienter (2 år gammel og ældre) med NDD-CKD eller PDD-CKD, der er på erythropoietinbehandling til jernvedligeholdelsesbehandling
Til jernvedligeholdelsesbehandling: Administrer venofer i en dosis på 0,5 mg/kg, der ikke overstiger 100 mg pr. Dosis hver fjerde uge i 12 uger, givet ufortyndet med langsom intravenøs injektion over 5 til 60 minutter eller fortyndet i 0,9% NaCI i en koncentration på 1 til 2 mg/ml og administreret over 5 til 60 minutter. Fortynd ikke til koncentrationer under 1 mg/ml [se Hvor leveret ] Venofer -behandling kan gentages om nødvendigt.
Doseringen til jernudskiftningsbehandling hos pædiatriske patienter med NDD-CKD eller PDD-CKD er ikke blevet etableret.
Hvor leveret
Doseringsformularer og styrker
Indsprøjtning
50 mg/2,5 ml 100 mg/5 ml eller 200 mg/10 ml (20 mg/ml) i enkeltdosis hætteglas. (3)
Opbevaring og håndtering
Venofer leveres steril i 10 ml 5 ml og 2,5 ml enkeltdosis hætteglas. Hvert 10 ml hætteglas indeholder 200 mg elementært jern hver 5 ml hætteglas indeholder 100 mgelementalt jern, og hver 2,5 ml hætteglas indeholder 50 mg elementært jern (20 mg/ml).
| NDC -0517-2310-05 | 200 mg/10 ml enkeltdosis hætteglas | Pakker på 5 |
| NDC -0517-2340-01 | 100 mg/5 ml enkeltdosis hætteglas | Individuelt bokset |
| NDC -0517-2340-10 | 100 mg/5 ml enkeltdosis hætteglas | Pakker på 10 |
| NDC -0517-2340-25 | 100 mg/5 ml enkeltdosis hætteglas | Pakker på 25 |
| NDC -0517-2325-10 | 50 mg/2,5 ml enkeltdosis hætteglas | Pakker på 10 |
Stabilitet og opbevaring
Indeholder ingen konserveringsmidler. Opbevares i original karton ved 20 ° C til 25 ° C (68 ° F til 77 ° F); Udflugter tilladt til 15 ° til 30 ° C (59 ° til 86 ° F) [se USP -kontrolleret rumtemperatur]. Frys ikke.
Sprøjte stabilitet
Venofer, når den blev fortyndet med 0,9% NaCI ved koncentrationer, der spænder fra 2 mg til 10 mg elementært jern pr. Ml eller ufortyndet (20 mg elementaliron pr. Ml) og opbevaret i en plastiksprøjte blev fundet at være fysisk og kemisk stabil i 7 dage ved kontrolleret stuetemperatur (25 ° C ± 2 ° C) og underfrigeration (4 ° C ° C).
Intravenøs blanding af blanding af blanding
Venofer, når den tilsættes til intravenøse infusionsposer (PVC eller ikke-PVC) indeholdende 0,9% NaCI ved koncentrationer, der spænder fra 1 mgto 2 mg elementært jern pr. Ml, har vist sig at være fysisk og kemisk stabile i 7 dage ved kontrolleret stuetemperatur (25 ° C ± 2 ° C).
Fortynd ikke til koncentrationer under 1 mg/ml.
Bland ikke venofer med andre medicin eller føj til parenterale ernæringsløsninger til intravenøs infusion.
Parenterale lægemiddelprodukter skal inspiceres visuelt for partikler og misfarvning inden infusion.
Venofer er fremstillet under licens fra VIFOR (International) Inc. Schweiz. Revideret: Jul 2022
Bivirkninger for venofer
Følgende klinisk signifikante bivirkninger er beskrevet andetsteds i mærkningen:
- Overfølsomhedsreaktioner [se Advarsler og forholdsregler ]
- Hypotension [se Advarsler og forholdsregler ]
- Jernoverbelastning [se Advarsler og forholdsregler ]
Bivirkninger i kliniske forsøg
Da kliniske forsøg udføres under vidt forskellige tilstande, kan der muligvis ikke afspejler de kliniske forsøg med et lægemiddel muligvis ikke de satser, der er serveret i praksis.
Bivirkninger hos voksne patienter med CKD
Hyppigheden af bivirkninger, der er forbundet med brugen af venofer, er blevet dokumenteret i seks kliniske forsøg, der involverede 231 patienter med HDD-CKD 139 patienter med NDD-CKD og 75 patienter med PDD-CKD. Bivirkninger rapporteret af ≥ 2% af de behandlede patienter i de seks kliniske forsøg, for hvilke hastigheden for venofer overstiger hastigheden for komparator, er anført ved indikation i tabel 1. Patienter med HDD-CKD modtog 100 mg doser ved 10 på hinanden følgende dialyse-sessioner, indtil en kumulativ dosis på 1000 mg blev administreret. Patienter med NDD-CKD modtog enten 5 doser på 200 mg over 2 uger eller 2 doser på 500 mg adskilt byfourteen dage, og patienter med PDD-CKD modtog 2 doser på 300 mg efterfulgt af en dosis på 400 mg over en periode på 4 uger.
Tabel 1. Bivirkninger rapporteret i ≥ 2% af undersøgelsespopulationer, og for hvilke RateFor Venofer overstiger hastigheden for komparator
| Kropssystem/bivirkninger | HDD-CKD | NDD-CKD | PDD-CKD | ||
| Venofer (N = 231) % | Venofer (N = 139) % | Oralt jern (N = 139) % | Venofer (N = 75) % | Kun epo* (N = 46) % | |
| Emner med enhver bivirkning | 78.8 | 76.3 | 73.4 | 72.0 | 65.2 |
| Øre- og labyrintforstyrrelser | |||||
| 0 | 2.2 | 0.7 | 0 | 0 | |
| Øjenlidelser | |||||
| 0.4 | 0 | 0 | 2.7 | 0 | |
| Gastrointestinale lidelser | |||||
| 3.5 | 1.4 | 2.9 | 4.0 | 6.5 | |
| 5.2 | 7.2 | 10.1 | 8.0 | 4.3 | |
| 0.9 | 7.9 | 0 | 0 | 0 | |
| 14.7 | 8.6 | 12.2 | 5.3 | 4.3 | |
| 9.1 | 5.0 | 8.6 | 8.0 | 2.2 | |
| Generelle lidelser og administrationsstedets forhold | |||||
| 2.2 | 0.7 | 2.2 | 2.7 | 0 | |
| 6.1 | 1.4 | 0 | 2.7 | 0 | |
| 3.0 | 0 | 0 | 0 | 0 | |
| 0 | 5.8 | 0 | 0 | 0 | |
| 0 | 2.2 | 0 | 0 | 0 | |
| 2.6 | 7.2 | 5.0 | 5.3 | 10.9 | |
| 3.0 | 0.7 | 0.7 | 1.3 | 0 | |
| Infektioner og angreb | |||||
| 2.6 | 2.2 | 4.3 | 16.0 | 4.3 | |
| Skadeforgiftning og proceduremæssige komplikationer | |||||
| 9.5 | 1.4 | 0 | 0 | 0 | |
| Metabolisme og ernæringsforstyrrelser | |||||
| 3.0 | 1.4 | 0.7 | 1.3 | 0 | |
| 0 | 2.9 | 1.4 | 0 | 0 | |
| 0 | 2.9 | 0 | 0 | 2.2 | |
| 0.4 | 0.7 | 0.7 | 4.0 | 0 | |
| Muskuloskeletale og bindevævsforstyrrelser | |||||
| 3.5 | 1.4 | 2.2 | 4.0 | 4.3 | |
| 2.2 | 2.2 | 3.6 | 1.3 | 4.3 | |
| 29.4 | 0.7 | 0.7 | 2.7 | 0 | |
| 0 | 3.6 | 0 | 1.3 | 0 | |
| 5.6 | 4.3 | 0 | 2.7 | 6.5 | |
| Nervesystemforstyrrelser | |||||
| 6.5 | 6.5 | 1.4 | 1.3 | 4.3 | |
| 12.6 | 2.9 | 0.7 | 4.0 | 0 | |
| Respiratorisk thorax- og mediastinal lidelser | |||||
| 3.0 | 2.2 | 0.7 | 1.3 | 0 | |
| 3.5 | 5.8 | 1.4 | 1.3 | 2.2 | |
| 0 | 1.4 | 2.2 | 1.3 | 0 | |
| Hud og subkutane vævsforstyrrelser | |||||
| 3.9 | 2.2 | 4.3 | 2.7 | 0 | |
| Vaskulære lidelser | |||||
| 6.5 | 6.5 | 4.3 | 8.0 | 6.5 | |
| 39.4 | 2.2 | 0.7 | 2.7 | 2.2 | |
| * Epo = erythropoietin |
Hundrede tredive (11%) af de 1151 patienter, der blev evalueret i de 4 amerikanske forsøg hos HDD-CKD-patienter (studier A B og de to postmarkedsundersøgelser) havde forudgående andre intravenøse jernterapi og blev rapporteret at være intolerante (defineret som udelukkende yderligere anvendelse af dette jernprodukt). Da disse patienter blev behandlet med venofer var der ingen forekomster af bivirkninger, der udelukkede yderligere brug af venofer [se Advarsel og forholdsregler ].
Bivirkninger hos pædiatriske patienter med CKD (i alderen 2 år og ældre)
I et randomiseret åbent dosisforsøg til jernvedligeholdelsesbehandling med venofer hos pædiatriske patienter med CKD på stabil erythropoietinbehandling [se Kliniske studier ] Mindst en bivirkning blev oplevet af 57% (27/47) af de patienter, der fik venofer 0,5 mg/kg 53% (25/47) af patienterne, der er tilrørende venofer 1 mg/kg og 55% (26/47) af de patienter, der modtog Venofer 2 mg/kg.
I alt 5 (11%) forsøgspersoner i Venofer 0,5 mg/kg gruppe 10 (21%) patienter i Venofer 1 mg/kg -gruppen og 10 (21%) patienter i Venofer 2 mg/kg GroupExperienced mindst 1 alvorlig bivirkning under undersøgelsen. De mest almindelige bivirkninger (> 2%af patienterne) hos alle patienter var hovedpine (6%) luftvejsvirusinfektion (4%) peritonitis (4%) opkast (4%) pyrexia (4%) svimmelhed (4%) hoste (4%) kvalme (3%) arteriovenøs fistula -thrombose (2%) hypotension (2%) og hypert (1%).
Bivirkninger fra oplevelse efter markedsføring
Følgende bivirkninger er blevet identificeret under anvendelse af venofer efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en populationsstørrelse, er det ikke altid muligt at pålideligt estimere deres frekvens eller etablere et årsagsforhold til eksponering for lægemidler.
I sikkerhedsundersøgelserne efter markedsføring hos 1051 behandlede patienter med HDD-CKD de bivirkninger rapporteret af> 1% var hjertesvigt kongestiv sepsis og dysgeusia.
- Immunsystemforstyrrelser: Anafylaktisk type reaktioner angioødem
- Psykiatriske lidelser: forvirring
- Nervesystemforstyrrelser: kramper kollapser lyshøjde-tab af bevidsthed
- Kardiovaskulært system: Bradycardia stød Akut myokardisk iskæmi med eller uden myokardieinfarkt eller med in-stent trombose i sammenhæng med ahypersensitivitetsreaktion
- Respiratorisk thorax- og mediastinal lidelser: Bronchospasme dyspnø
- Muskuloskeletale og bindevævsforstyrrelser: Rygsmerter swelling of the joints
- Nyre- og urinforstyrrelser: chromaturia
- Generelle lidelser og administrationsstedets forhold: Hyperhidrose
Symptomer forbundet med Venofer -total dosering eller infunderet for hurtigt inkluderede hypotension dyspnø Hovedpine opkast kvalme svimmelhed Fællesskaber åtfra Abdominal og muskelsmerterødem og kardiovaskulær sammenbrud. Disse bivirkninger har forekommet op til 30 minutter efter indgivelse af venofer -injektion. Reaktioner har forekommet efter den første dosis eller efterfølgende doser af venofer. Symptomer kan reagere på intravenøse væsker hydrocortisonand/eller antihistaminer. At bremse infusionshastigheden kan lindre symptomer.
Indsprøjtning site discolelleration has been repellerted following extravasation. Assure stable intravenous access to avoid extravasation.
Lægemiddelinteraktioner for venofer
Venofer may reduce the absellerption of concomitantly administered elleral iron preparations.
Hvilken klasse af antibiotikum er clindamycin
Advarsler for Venofer
Inkluderet som en del af 'FORHOLDSREGLER' Afsnit
Forholdsregler for venofer
Overfølsomhedsreaktioner
Alvorlige overfølsomhedsreaktioner, herunder reaktioner af anafylaktisk type, hvoraf nogle har været livstruende og dødelige, er rapporteret hos patienter, der er tilbagevendende venofer. Patienter kan præsentere med chok klinisk signifikant hypotensionstab af bevidsthed og/eller sammenbrud. Hvis overfølsomhedsreaktioner eller tegn på intolerance forekommer under administrationsstop venofer med det samme. Overvåg patienter for tegn og symptomer på overfølsomhed under og efter venoferadministration i mindst 30 minutter og indtil klinisk stabil efter afslutningen af infusionen. Administrer kun venofer, når personale og terapier er tilgængelige til behandling af alvorlige overfølsomhedsreaktioner. De fleste reaktioner, der er forbundet med intravenøse jernpræparater, forekommer inden for 30 minutter af afslutningen af infusionen [se Bivirkninger ].
Hypotension
Venofer may cause clinically significant hypotension. Moniteller feller signs og symptoms of hypotension following each administration of Venofer. Hypotensionfollowing administration of Venofer may be related to the rate of administration og/eller total dose administered [see Dosering og administration Overfølsomhedsreaktioner og Bivirkninger ].
Jernoverbelastning
Overdreven terapi med parenteralt jern kan føre til overskydende opbevaring af jern med mulighed for iatrogen hæmosiderose. Alle voksne og pædiatriske patienter, der modtager afknytning, kræver periodisk overvågning af hæmatologiske og jernparametre ( hæmoglobin Hematokrit serumferritin og transferrinmætning). Administrer ikke den til patienter med tegn på overbelastning af jern. Transferrin mætning (TSAT) -værdier stiger hurtigt efter intravenøs indgivelse af jernsakrose; Gør NotPerform serumjernmålinger i mindst 48 timer efter intravenøs dosering [se Dosering og administration og OVERDOSIS ].
Ikke -klinisk toksikologi
Karcinogenese mutagenese nedskrivning af fertilitet
Karcinogenicitetsundersøgelser er ikke blevet udført med jernsaccharose.
Jernsakrose var ikke mutagen In vitro I bakteriel omvendt mutationsassay (AMES -test) eller muselymfomassayet. Iron Saccharose var ikke klastogen i In vitro Kromosomafvigelsesassay ved hjælp af humane lymfocytter eller i forgæves Musmikronukleusassay.
Jernsakrose ved intravenøse doser op til 15 mg/kg/dag elementært jern (1,2 gange den maksimale anbefalede humane dosis baseret på kropsoverfladeareal) havde nogen effekt på fertilitet og reproduktiv funktion af han- og hunrotter.
Brug i specifikke populationer
Graviditet
Risikooversigt
Offentliggjorte undersøgelser af intravenøs jernsakrosebehandling efter den første trimester af graviditeten har ikke vist ugunstige moderlige eller føtal resultater (se Data ). Tilgængelige rapporter om intravenøs jernsucharose -brug hos gravide kvinder i første trimester er utilstrækkelige til at vurdere risikoen for store fødselsdefekter ogMiscarriage. Der er risici for moderen og fosteret forbundet med ubehandlet IDA i graviditet såvel som risici for fosteret forbundet med mødre alvorlige hypersensitivitetsreaktioner (se Kliniske overvejelser ). Dyreforgivelsesundersøgelser af jernsakrose indgivet til rotter og kaniner i perioden af organisatoriskenese ved elementære jerndoser svarende til den maksimale anbefalede menneskelige dosis baseret på kropsoverfladeareal afslørede intet bevis for skade på fosteret (se Data ). The estimated background risk of majeller birth defects og miscarriage feller the indicated populations is unknown. Adverse outcomes in pregnancy occurregardless of the health of the mother eller the use of medications. In the U.S. general population the estimated background risk of majeller birth defects ogmiscarriage in clinically-recognized pregnancies is 2-4% og 15-20% respectively.
Kliniske overvejelser
Sygdomsassocieret moderlig og/eller embryo/føtal risiko
Jernmangelanæmi under graviditet skal behandles. Ubehandlet IDA i graviditeten er forbundet med ugunstige moderlige resultater, såsom post-partum-anæmi. Adgangs graviditetsresultater forbundet med IDA inkluderer øget risiko for for tidlig levering og lav fødselsvægt.
Fetal/Neonatal adverse reactions
Alvorlige bivirkninger, herunder kredsløbssvigt (alvorligt hypotensionschok, herunder i sammenhæng med anafylaktisk reaktion) kan forekomme hos gravide kvinder med parenterale jernprodukter (såsom Venofer), som kan forårsage føtal bradykardi, især i det andet og tredje trimester.
Data
Menneskelige data
Publicerede data fra randomiserede kontrollerede studier og potentielle observationsundersøgelser om brugen af venofer hos gravide kvinder har ikke rapporteret om en tilknytning af Venofer og ugunstige udviklingsresultater. Imidlertid inkluderede disse undersøgelser ikke kvinder, der blev udsat i første trimester af graviditeten, og blev ikke -designet til at vurdere risikoen for store fødselsdefekter. Moders bivirkninger rapporteret i disse undersøgelser svarer til dem, der er rapporteret under kliniske forsøg hos voksne mænd og ikke-gravide hunner [se Bivirkninger ].
Dyredata
Iron Sucrose blev indgivet intravenøst til rotter og kaniner i perioden med organogenese ved elementære jerndoser op til 13 mg/kg/dag (0,25 gange malme quivalent til den maksimale anbefalede menneskelige dosis baseret på kropsoverfladeareal) og afslørede intet bevis for skade for fetus.
Amning
Risikooversigt
Iron Sucrose er til stede i human mælk og tilgængelige offentliggjorte rapporter efter eksponering for 100-300 mg intravenøs jernsakrose har ikke rapporteret modvirker i ammede spædbørn (se Data ). There are no data on the effects on milk production. The developmental og health benefits of breastfeeding should beconsidered along with the mother’s clinical need feller Venofer og any potential adverse effects on the breastfed child from Venofer eller from the underlying maternalcondition.
Data
En offentliggjort undersøgelse viste ingen forskel i jernkoncentration i colostrum af 10 jernmangel ammende kvinder, der var 2 til 3 dage efter fødslen Andreceived en enkelt dosis på 100 mg intravenøs jernsakrose sammenlignet med 5 ammende kvinder, der ikke modtog noget jern. Disse resultater kan undervurdere teamount af jern i brystmælk efter standarddosis af venofer.
En offentliggjort rapport af 78 ammende kvinder, der modtog 300 mg intravenøs jernsakrose over 3 dage (spædbarnsalder ikke rapporteret) rapporterede ikke om sikkerheden af jernsakrose hos ammede spædbørn; Imidlertid blev bivirkninger hos ammede spædbørn ikke rapporteret.
Kliniske overvejelser
Overvåg ammede spædbørn til gastrointestinal toksicitet (forstoppelsesdiarré).
Pædiatrisk brug
Sikkerhed og effektivitet af Venofer til jernudskiftningsbehandling hos pædiatriske patienter med dialyseafhængig eller ikke-dialyseafhængig CKD er ikke blevet fastlagt.
Sikkerhed og effektivitet af Venofer til jernvedligeholdelsesbehandling hos pædiatriske patienter 2 år og ældre med dialyseafhængig eller ikke-dialyseafhængig af modtagelse af erythropoietin-terapi blev undersøgt. Venofer ved doser på 0,5 mg/kg 1 mg/kg og 2 mg/kg blev administreret. Alle tre doser opretholdt hemoglobin mellem 10,5 g/dL og 14,0 g/dL hos ca. 50% af personerne i løbet af 12-ugers behandlingsperiode med stabil EPO-dosering [Se Kliniske studier ]. Venofer has not been studied in patients younger than 2 years of age.
I et land, hvor Venofer er tilgængelig til brug hos børn på et enkelt sted fem for tidlige spædbørn (vægt mindre end 1250 g) udviklede nekrotiserende enterocolitis og de fem døde i eller efter en periode, hvor de modtog venofer flere andre medicin og erythropoietin. Nekrotiserende enterocolitis kan være kompliceret af prematuritet hos spædbørn med meget lav fødselsvægt. Intet årsagsforhold til Venofer eller andre lægemidler kunne etableres.
Geriatrisk brug
Af de 1051 patienter i to sikkerhedsundersøgelser efter markedsføring af Venofer var 40% 65 år og ældre. Der blev ikke observeret nogen samlede forskelle i sikkerhed eller effektivitet mellem disse forsøgspersoner, og yngre forsøgspersoner og andre rapporterede kliniske erfaringer har ikke identificeret forskelle i svar mellem ældre og yngre patienter, men større følsomhed for nogle ældre personer kan ikke udelukkes. Generelt skal dosisadministration til en ældre patient være forsigtig med at afspejle den greater -frekvens af nedsat lever -nyre- eller hjertefunktion og af samtidig sygdom eller anden lægemiddelterapi.
Overdoseringsoplysninger til Venofer
Ingen data er tilgængelige om overdosering af Venofer hos mennesker. Overdreven doser af Venofer kan føre til ophobning af jern på opbevaringssteder, der potentielt er at være til hæmosiderose. Administrer ikke venofer til patienter med jernoverbelastning [se Advarsler og forholdsregler ]. Venofer is not dialyzable through CA210(Baxter) High Efficiency eller Fresenius F80A High Flux dialyse membranes.
Toksiciteter i enkeltdosisundersøgelser hos mus og rotter ved intravenøs jernsakrosedoser op til 8 gange den maksimale anbefalede humane dosis baseret på kropsoverfladea inkluderede sedationshypoaktivitet blege øjne blødning i mave-tarmkanalen og lungerne og dødeligheden.
Kontraindikationer for venofer
- Kendt overfølsomhed over for Venofer.
Klinisk farmakologi feller Venofer
Handlingsmekanisme
Venofer is an aqueous complex of poly-nuclear iron (III)-hydroxide in sucrose. Following intravenous administration Venofer is dissociated into iron og sucroseog the iron is transpellerted as a complex with transferrin to target cells including erythroid precurseller cells. The iron in the precurseller cells is incellerpellerated intohæmoglobin as the cells mature into red blood cells.
Farmakodynamik
Efter intravenøs administration er venofer dissocieret i jern og saccharose. Hos 22 patienter, der gennemgik hæmodialyse og modtagelse af erythropoietin (rekombinant human erythropoietin) terapi behandlet med jernsaccharose indeholdende 100 mg jern tre gange ugentligt i tre ugers betydelige stigninger i serumiron og serumferritin og signifikante fald i total jernbindingskapacitet opstod fire uger fra initiering af jernrekulle -behandling.
Farmakokinetik
Hos raske voksne administrerede intravenøse doser af venofer udviste dens jernkomponent første orden kinetik med en eliminering halveringstid på 6 timers total clearance af 1,2 l/h og stabil tilstand tilsyneladende mængde fordeling på 7,9 L. Jernkomponenten syntes at fordele hovedsageligt i blod og til en vis grad i ekstravaskulærfluid. En undersøgelse, der evaluerer venofer, der indeholder 100 mg jern mærket med 52Fe/Fe59 Hos patienter med jernmangel viste det, at en betydelig mængde af de mesterede jern distribueres til levermilt og knoglemarv, og at knoglemarven er et irreversibelt jernfangstrum.
hvordan man bøjes efter at have taget imodium
Efter intravenøs administration af venofer jernsaccharose dissocieres i jern og saccharose. Saccharose -komponenten elimineres hovedsageligt ved urinærekretion. I en undersøgelse, der vurderede en enkelt intravenøs dosis af venofer, der indeholder 1510 mg saccharose og 100 mg jern hos 12 raske voksne (9 kvindelige 3 mandlige: Agerange 32 til 52) 68,3% af saccharosen blev fjernet i urin i 4 timer og 75,4% i 24 timer. Nogle jern blev også fjernet i urinen. Hverken transferrin eller transferrinreceptorniveauer ændrede sig umiddelbart efter dosisadministrationen. I denne undersøgelse og en anden undersøgelse, der evaluerede en enkelt intravenøs dosis af jernsukrosikkerhed 500 til 700 mg jern hos 26 patienter med anæmi på erythropoietin -terapi (23 kvinder 3 mandlige; aldersområde 16 til 60) ca. 5% af jern varelimineret i urin i 24 timer ved hver dosisniveau. Virkningerne af alder og køn på farmakokinetikken for Venofer er ikke undersøgt.
Farmakokinetik In Pediatric Patients
I en enkeltdosis PK-undersøgelse af venofer-patienter med NDD-CKD i alderen 12 til 16 (n = 11) modtog intravenøse bolusdoser af venofer ved 7 mg/kg (maksimal 200 mg) indgivet over 5 minutter. Efter en enkelt dosis venofer var halveringstiden for det samlede serumjern 8 timer. De gennemsnitlige Cmax- og AUC-værdier var 8545 μg/Dland 31305 timer • μg/DL, som var 1,42- og 1,67 gange højere end dosisjusteret voksen Cmax og AUC-værdier.
Venofer is not dialyzable through CA210 (Baxter) High Efficiency eller Fresenius F80A High Flux dialyse membranes. In In vitro Undersøgelser Mængden af jernsaccharosein Dialysatvæsken var under niveauerne af detektion af assayet (mindre end 2 dele pr. Million).
Kliniske studier
Fem kliniske forsøg, der involverede 647 voksne patienter og et klinisk forsøg, der involverede 131 pædiatriske patienter, blev udført for at vurdere sikkerheden og effektiviteten af Venofer.
Kliniske studier Overview
Fem kliniske forsøg, der involverede 647 voksne patienter og et klinisk forsøg, der involverede 131 pædiatriske patienter, blev udført for at vurdere sikkerheden og effektiviteten af Venofer.
Undersøg a
Hemodialyse-afhængig-kronisk nyresygdom (HDD-CKD)
Undersøg a was a multicenter open-label histellerically-controlled study in 101 patients with HDD-CKD (77 patients with Venofer treatment og 24 in the histellericalcontrol group) with IDA. Eligibility criteria feller Venofer treatment included patients undergoing chronic hemodialyse receiving erythropoietin hæmoglobin levelbetween 8.0 og 11.0 g/dL transferrin saturation <20% og serum ferritin <300 ng/mL. The mean age of the patients was 65 years with the age range of 31 to 85years. Of the 77 patients 44 (57%) were male og 33 (43%) were female.
Venofer 100 mg was administered at 10 consecutive dialyse sessions either as slow injection eller a slow infusion. The histellerical control population consisted of 24patients with similar ferritin levels as patients treated with Venofer who were off intravenous iron feller at least 2 weeks og who had received erythropoietin therapywith hematocrit averaging 31 to 36 feller at least two months prieller to study entry. The mean age of patients in the histellerical control group was 56 years with an agerange of 29 to 80 years. Patient age og serum ferritin level were similar between treatment og histellerical control patients.
Patienter i venofer -behandlet population viste en større stigning i hæmoglobin og hæmatokrit end patienter i den historiske kontrolpopulation. Se tabel 2.
Tabel 2. Ændringer fra baseline i hæmoglobin og hæmatokrit
| Effektivitetsparametre | Slut på behandlingen | 2 ugers opfølgning | 5 ugers opfølgning | |||
| Venofer (n=69) | Historisk kontrol (n = 18) | Venofer (n = 73) | Historisk kontrol (n = 18) | Venofer (n = 71) | Historisk kontrol (n = 15) | |
| Hemoglobin (G/DL) | 1,0 ± 0,12 ** | 0,0 ± 0,21 | 1,3 ± 0,14 ** | -0,6 ± 0,24 | 1,2 ± 0,17* | -0,1 ± 0,23 |
| Hæmatokrit (%) | 3,1 ± 0,37 ** | -0,3 ± 0,65 | 3,6 ± 0,44 ** | -1,2 ± 0,76 | 3,3 ± 0,54 | 0,2 ± 0,86 |
| ** s <0.01 og *p < 0.05 compared to histellerical control from ANCOVA analysis with baseline hæmoglobin serum ferritin og erythropoietin dose as covariates. |
Serumferritin steg ved slutpunktet for studiet fra baseline i den venofer-behandlede population (165,3 ± 24,2 ng/ml) sammenlignet med den historiske kontrolpopulation (-27,6 ± 9,5 ng/ml). Transferrin-mætning steg også ved slutpunktet for studiet fra baseline i den venofer-behandlede population (8,8 ± 1,6%) sammenlignet med denne historiske kontrolpopulation (-5,1 ± 4,3%).
Undersøgelse b
Hemodialyse-afhængig-kronisk nyresygdom (HDD-CKD)
Undersøgelse b was a multicenter open label study of Venofer in 23 patients with iron deficiency og HDD-CKD who had been discontinued from iron dextran due tointolerance. Eligibility criteria were otherwise identical to Undersøg a. The mean age of the patients in this study was 53 years with ages ranging from 21 to 79 years.Of the 23 patients enrolled in the study 10 (44%) were male og 13 (56%) were female.
Alle 23 tilmeldte patienter blev evalueret for effektivitet. Stigninger i gennemsnitlig hæmoglobin (1,1 ± 0,2 g/dL) hæmatokrit (3,6 ± 0,6%) serumferritin (266,3 ± 30,3 ng/ml) og transferrinmætning (8,7 ± 2,0%) blev observeret fra baseline til slutningen af behandlingen.
Undersøgelse c
Hemodialyse-afhængig-kronisk nyresygdom (HDD-CKD)
Undersøgelse c was a multicenter open-label study in patients with HDD-CKD. This study enrolled patients with a hæmoglobin ≤ 10 g/dL a serum transferrin saturation ≤20% og a serum ferritin ≤ 200 ng/mL who were undergoing maintenance hemodialyse 2 to 3 times weekly. The mean age of the patients enrolled in this studywas 41 years with ages ranging from 16 to 70 years. Of 130 patients evaluated feller efficacy in this study 68 (52%) were male og 62 (48%) were female. Fellerty-eight percent of the patients had previously been treated with elleral iron. Exclusion criteria were similar to those in studies A og B. Venofer was administered indoses of 100 mg during sequential dialyse sessions until a pre-determined (calculated) total dose of iron was administered. A 50 mg dose (2.5 mL) was given topatients within two weeks of study entry as a test dose. Twenty-seven patients (20%) were receiving erythropoietin treatment at study entry og they continued tellereceive the same erythropoietin dose feller the duration of the study.
Den modificerede intention-to-treat (MITT) population bestod af 131 patienter. Stigninger fra baseline i gennemsnitlig hæmoglobin (1,7 g/dL) hæmatokrit (5%) serumferritin (434,6 ng/ml) og serumoverføringsmætning (14%) blev observeret i uge 2 i observationsperioden, og disse værdier forblev øget i uge 4 af observationsperioden.
Undersøgelse d
Ikke-dialyseafhængig-kronisk nyresygdom (NDD-CKD)
Undersøgelse d (NCT00236977) was a rogomized open-label multicenter active-controlled study of the safety og efficacy of elleral iron versus Venofer in patients withNDD-CKD with eller without erythropoietin therapy. Erythropoietin therapy was stable feller 8 weeks prieller to rogomization. In the study 188 patients with NDD-CKDhæmoglobin of ≤ 11.0 g/dL transferrin saturation ≤ 25% ferritin ≤ 300 ng/mL were rogomized to receive elleral iron (325 mg ferrous sulfate three times daily feller 56days); eller Venofer (either 200 mg over 2 to 5 minutes 5 times within 14 days eller two 500 mg infusions on Day 1 og Day 14 administered over 3.5 to 4 hours). Themean age of the 91 treated patients in the Venofer group was 61.6 years (range 25 to 86 years) og 64 years (range 21 to 86 years) feller the 91 patients in the elleral irongroup.
En statistisk signifikant større andel af venofer -personer (35/79; 44,3%) sammenlignet med orale jernpersoner (23/82; 28%) havde en stigning i hæmoglobin ≥ 1G/DL når som helst under undersøgelsen (P = 0,03).
Undersøgelse e
Peritoneal dialyseafhængig-kronisk nyresygdom (PDD-CKD)
Undersøgelse e (NCT00236938) was a rogomized open-label multicenter study comparing patients with PDD-CKD receiving an erythropoietin og intravenous iron topatients with PDD-CKD receiving an erythropoietin alone without iron supplementation. Patients with PDD-CKD stable erythropoietin feller 8 weeks hæmoglobinof ≤ 11.5 g/dL TSAT ≤ 25% ferritin ≤ 500 ng/mL were rogomized to receive either no iron eller Venofer (300 mg in 250 mL 0.9% NaCl over 1.5 hours on Day 1og 15 og 400 mg in 250 mL 0.9% NaCl over 2.5 hours on Day 29). The mean age of the 75 treated patients in the Venofer / erythropoietin group was 51.9 years(range 21 to 81 years) vs. 52.8 years (range 23 to 77 years) feller 46 patients in the erythropoietin alone group.
Patienter i Venofer/Erythropoietin -gruppen havde statistisk signifikant større gennemsnitlig ændring fra baseline til den højeste hæmoglobinværdi (1,3 g/dL) sammenlignet med forsøgspersoner, der modtog erythropoietin alene (0,6 g/dL) (p <0.01). A greater propellertion of subjects treated with Venofer / erythropoietin (59.1 %) had anincrease in hæmoglobin of ≥ 1 g/dL at any time during the study compared to the subjects who received erythropoietin only (33.3%).
Undersøgelse f
Jernvedligeholdelsesbehandling Dosering hos pædiatriske patienter i alderen 2 år og ældre med kronisk nyresygdom
Undersøgelse f (NCT00239642) was a rogomized open-label dose-ranging study feller iron maintenance treatment in pediatric patients with dialyse-dependent eller non-dialyse-dependent CKD on stable erythropoietin therapy. The study rogomized patients to one of three doses of Venofer (0.5 mg/kg 1 mg/kg eller 2 mg/kg). Themean age was 13 years (range 2 to 20 years). Over 70% of patients were 12 years eller older in all three groups. There were 84 males og 61 females. About 60% ofpatients underwent hemodialyse og 25% underwent peritoneal dialyse in all three dose groups. At baseline the mean hæmoglobin was 12 g/dL the mean TSATwas 33% og the mean ferritin was 300 ng/mL. Patients with HDD-CKD received Venofer once every other week feller 6 doses. Patients with PDD-CKD eller NDD-CKD received Venofer once every 4 weeks feller 3 doses. Among 131 evaluable patients with stable erythropoietin dosing the propellertion of patients who maintainedhæmoglobin between 10.5 g/dL og 14.0 g/dL during the 12-week treatment period was 58.7% 46.7% og 45.0% in the Venofer 0.5 mg/kg 1 mg/kg og 2 mg/kggroups respectively. A dose-response relationship was not demonstrated.
Patientinformation til venofer
Tidligere historie med reaktioner på parenterale jernprodukter
Spørgsmål Patienter vedrørende enhver tidligere historie med reaktioner på parenterale jernprodukter [se Advarsler og forholdsregler ].
Alvorlige overfølsomhedsreaktioner
Rådgiv patienter om at rapportere eventuelle symptomer på overfølsomhed, der kan udvikle sig under og efter venofer-administration, såsom udslæt kløe svimmelhed lettehed og åndedrætsproblemer [se Advarsler og forholdsregler ].