Apidra
Oplysningerne På Webstedet Er Ikke Medicinsk Rådgivning. Vi Sælger Ikke Noget. Nøjagtigheden Af Oversættelsen Er Ikke Garanteret. Ansvarsfraskrivelse
Resume af lægemiddeloversigt
Hvad er Apidra?
Apidra (insulin glulisin [rDNA Origin] Inj) er et hormon, der produceres i kroppen, der bruges til behandling af diabetes hos voksne og børn, der er mindst 4 år gamle. Apidra gives normalt sammen med en langtidsvirkende insulin.
Hvad er bivirkninger af Apidra?
Almindelige bivirkninger af Apidra inkluderer:
- reaktioner på injektionsstedet (smerte rødme eller irritation).
Apidra kan forårsage lavt blodsukker (hypoglykæmi). Fortæl din læge, hvis du oplever symptomer på lavt blodsukker, inklusive pludselig svedende ryster (rysten) hurtig hjerteslag Hunger sløret syn Svimmelhed prikkende hænder/fødder Hovedpine kvalme forvirring døsighed Svaghed Besvær Bede med at koncentrere forvirring eller beslaglæggelse (kramper). Fortæl din læge, hvis du har alvorlige bivirkninger af Apidra, herunder:
- Tegn på lavt kaliumniveau i blodet (såsom muskelkramper svaghed uregelmæssig hjerteslag).
Dosering til Apidra
Doseringen af Apidra er individualiseret. Blodglukoseovervågning er vigtig. Det samlede daglige insulinbehov kan variere og er normalt mellem 0,5 til 1 enhed/kg/dag.
Hvilke stoffer stoffer eller kosttilskud interagerer med Apidra?
Apidra kan interagere med albuterol-clonidin-guanethidin-lanreotid-niacin-octreotid-pramlintidreserpin eller betablokkere. Mange andre lægemidler kan øge eller mindske virkningerne af Apidra på at sænke dit blodsukker. Fortæl din læge alle receptpligtige og over-the-counter medicin og kosttilskud, du bruger. Fortæl din læge, hvis du er gravid, før du bruger Apidra. Hvis du planlægger graviditet, skal du diskutere en plan for styring af dine blodsukker med din læge, før du bliver gravid. Din læge kan skifte den type insulin, du bruger under graviditet. Det er ukendt, om dette stof passerer til modermælk. Kontakt din læge inden amning.
Yderligere oplysninger
Vores Apidra (insulin glulisin [rDNA Origin] Inj) bivirkninger Drug Center giver et omfattende overblik over tilgængelige lægemiddelinformation om de potentielle bivirkninger, når du tager denne medicin.
FDA -lægemiddelinformation
- Lægemiddelbeskrivelse
- Indikationer
- Bivirkninger
- Lægemiddelinteraktioner
- Advarsler
- Overdosis
- Klinisk farmakologi
- Medicin vejledning
Beskrivelse for Apidra
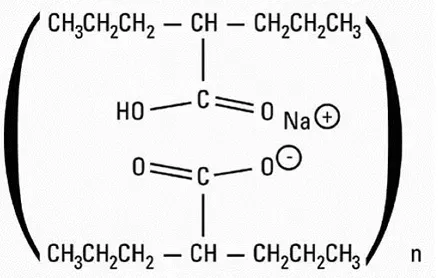
Apidra® (insulin glulisininjektion) er en hurtigvirkende human insulinanalog, der bruges til at sænke blodsukkeret. Insulin glulisin produceres ved rekombinant DNA-teknologi ved anvendelse af en ikke-patogen laboratoriebelastning af De udstillede chill (K12). Insulinglulisin adskiller sig fra humant insulin, idet aminosyre -asparaginen i position B3 erstattes af lysin, og lysinet i position B29 erstattes af glutinsyre. Kemisk insulin glulisin er 3B-Lysine-29BGlutaminsyre-human insulin har den empiriske formel C258H384N64O78S6 og en molekylvægt på 5823 og har følgende strukturelle formel:
 |
Apidra (insulin glulisine injection) is a sterile aqueous clear og colorless solution for subcutaneous or intravenous use. Each milliliter of Apidra contains 100 units (3.49 mg) insulin glulisine 3.15 mg metacresol 6 mg tromethamine 5 mg sodium chloride 0.01 mg polysorbate 20 og water for injection. Apidra has a pH of approximately 7.3. The pH is adjusted by addition of aqueous solutions of hydrochloric acid og/or sodium hydroxide.
Bruger til Apidra
Apidra is indicated to improve glycemic control in adults og children with diabetes mellitus.
Dosering til Apidra
Doseringsovervejelser
Apidra is a recombinant insulin analog that is equipotent to human insulin (i.e. one unit of Apidra has the same glucose-lowering effect as one unit of regular human insulin) when given intravenously. When given subcutaneously Apidra has a more rapid onset of action og a shorter duration of action than regular human insulin.
Doseringen af Apidra skal individualiseres. Blodglukoseovervågning er vigtig hos alle patienter, der får insulinbehandling.
Det samlede daglige insulinbehov kan variere og er normalt mellem 0,5 til 1 enhed/kg/dag. Insulinbehov kan ændres under stressets store sygdom eller med ændringer i træningsmåltidsmønstre eller coadministerede lægemidler.
Subkutan administration
Apidra should be given within 15 minutes before a meal or within 20 minutes after starting a meal.
Apidra given by subcutaneous injection should generally be used in regimens with an intermediate or long-acting insulin.
Apidra should be administered by subcutaneous injection in the abdominal wall thigh or upper arm. Injection sites should be rotated within the same region (abdomen thigh or upper arm) from one injection to the next to reduce the risk of lipodystrophy [See Bivirkninger ].
Kontinuerlig subkutan infusion (insulinpumpe)
Apidra may be administered by continuous subcutaneous infusion in the abdominal wall. Do not use diluted or mixed insulins in external insulin pumps. Infusion sites should be rotated within the same region to reduce the risk of lipodystrophy [See Bivirkninger ]. The initial programming of the external insulin infusion pump should be based on the total daily insulin dose of the previous regimen.
Følgende insulinpumper † er blevet anvendt i Apidra kliniske forsøg udført af Sanofiaventis Producenten af Apidra:
- Disetronic® H-Tron® Plus V100 og D-Tron® med disetroniske katetre (Rapid ™ Rapid C ™ Rapid D ™ og Tender ™)
- Minimed® Models 506 507 507c og 508 med minimerede katetre (SOF-set Ultimate QR ™ og Quick-Set ™).
Før du bruger en anden insulinpumpe med Apidra, skal du læse pumpemærket for at sikre, at pumpen er blevet evalueret med Apidra.
Læger og patienter skal omhyggeligt evaluere oplysninger om pumpebrug i Apidra, der ordinerer information om information om patientoplysninger og pumpeproducentens manual. Apidra-specifikke oplysninger skal følges for tidsfrekvens i brug af ændring af infusionssæt eller andre detaljer, der er specifikke for Apidra-brug, fordi Apidra-specifik information kan afvige fra generelle pumpevejledninger. Undladelse af at følge Apidra-specifikke instruktioner kan føre til alvorlige bivirkninger.
Patienter, der administrerer Apidra ved kontinuerlig subkutan infusion, skal have et alternativt insulinleveringssystem i tilfælde af pumpesystemfejl.
Baseret på In vitro Undersøgelser, der har vist tab af det konserveringsmiddel Metacresol og insulinnedbrydning Apidra i reservoiret, skal ændres mindst hver 48 time. Apidra bør ikke udsættes for temperaturer over 98,6 ° F (37 ° C). I klinisk brug skal infusionssæt og Apidra i reservoiret ændres mindst hver 48 time [se Advarsler og FORHOLDSREGLER og Hvor leveret / Opbevaring og håndtering ].
Intravenøs administration
Apidra can be administered intravenously under medical supervision for glycemic control with close monitoring of blood glucose og serum potassium to avoid hypoglycemia og hypokalemia. For intravenous use Apidra should be used at concentrations of 0.05 Units/mL to 1 Unit/mL insulin glulisine in infusion systems using polyvinyl chloride (PVC) bags. Apidra has been shown to be stable only in normal saline solution (0.9% sodium chloride). Parenteral drug products should be inspected visually for particulate matter og discoloration prior to administration whenever solution og container permit. Do not administer insulin mixtures intravenously.
Hvor leveret
Doseringsformularer og styrker
Apidra 100 enheder pr. Ml (U-100) er tilgængelig som:
- 10 ml hætteglas
- 3 ml Solostar -præfyldt pen
Opbevaring og håndtering
Apidra 100 enheder pr. Ml (U-100) er tilgængelig som:
10 ml hætteglas NDC 0088-2500-33
3 ml Solostar -præfyldt pen package of 5 NDC 0088-2502-05
Pen nåle er ikke inkluderet i pakkerne.
Solostar er kompatibel med alle penne nåle fra Becton Dickinson og Company Ypsomed og Owen Mumford.
Opbevaring
Brug ikke efter udløbsdatoen (se karton og beholder).
Uåbnet hætteglas/Solostar
Uåbnede Apidra-hætteglas og Solostar skal opbevares i et køleskab 36 ° F-46 ° F (2 ° C (2 ° C). Beskyt mod lys. Apidra bør ikke opbevares i fryseren, og det bør ikke have lov til at fryse. Kasser, hvis det er frosset. Uåbnede hætteglas/Solostar, der ikke er opbevaret i et køleskab, skal bruges inden for 28 dage.
Åben (i brug) hætteglas
Åbnede hætteglas, uanset om det er kølet, skal bruges inden for 28 dage. Hvis køling ikke er mulig, kan det åbne hætteglas, der er i brug, holdes ikke -køleskab i op til 28 dage væk fra direkte varme og lys, så længe temperaturen ikke er større end 25 ° C (25 ° C).
Åben (i-brug) Solostar-præfyldt pen
Den åbnede (indvendige) Solostar bør ikke køles, men bør holdes under 77 ° C (25 ° C væk fra direkte varme og lys. Den åbnede (i brug) Solostar opbevares ved stuetemperatur skal kasseres efter 28 dage.
Infusionssæt
Infusionssæt (reservoirs tubing og catheters) og the Apidra in the reservoir must be discarded after 48 hours of use or after exposure to temperatures that exceed 98.6°F (37°C).
Intravenøs brug
Infusionsposer tilberedt som angivet under Dosering og administration er stabile ved stuetemperatur i 48 timer.
Forberedelse og håndtering
Efter fortynding til intravenøs brug skal løsningen inspiceres visuelt for partikler og misfarvning inden administration. Brug ikke løsningen, hvis den er blevet overskyet eller indeholder partikler; Brug kun, hvis det er klart og farveløst. Apidra er ikke kompatibel med dextrose -opløsning og ringereopløsning og kan derfor ikke bruges med disse opløsningsvæsker. Brugen af Apidra med andre løsninger er ikke undersøgt og anbefales derfor ikke.
Sanofi-Aventis U.S. LLC Bridgewater NJ 08807 A Sanofi Company. Revisionsdato: 05/2014
Bivirkninger for Apidra
Følgende bivirkninger diskuteres andetsteds:
- Hypoglykæmi [se Advarsler og FORHOLDSREGLER ]
- Hypokalæmi [se Advarsler og FORHOLDSREGLER ]
Klinisk forsøgsoplevelse
Da kliniske forsøg udføres under vidt forskellige designs, kan de bivirkningsrater, der er rapporteret i et klinisk forsøg, muligvis ikke let sammenlignes med de hastigheder, der er rapporteret i et andet klinisk forsøg, og muligvis ikke afspejler de satser, der faktisk er observeret i klinisk praksis.
Frekvenserne af bivirkninger af lægemiddelreaktioner under Apidra -kliniske forsøg hos patienter med type 1 -diabetes mellitus og type 2 -diabetes mellitus er anført i nedenstående tabeller.
Tabel 1: Behandling –Engent bivirkninger i samlede undersøgelser af voksne med type 1 -diabetes (bivirkninger med frekvens ≥ 5%)
| Apidra % (n = 950) | Alle komparatorera % (n = 641) | |
| Nasopharyngitis | 10.6 | 12.9 |
| Hypoglykæmib | 6.8 | 6.7 |
| Øvre luftvej | 6.6 | 5.6 |
| Influenza | 4.0 | 5.0 |
| a Insulin Lispro Regular humant insulin Insulin Aspart b Kun alvorlig symptomatisk hypoglykæmi |
Tabel 2: Behandling –Engent bivirkning i samlede undersøgelser af voksne med type 2 -diabetes (bivirkninger med frekvens ≥ 5%)
| Apidra % (n = 883) | Regelmæssig human insulin % (n = 883) | |
| Øvre luftvej infection | 10.5 | 7.7 |
| Nasopharyngitis | 7.6 | 8.2 |
| Ætemperiferisk | 7.5 | 7.8 |
| Influenza | 6.2 | 4.2 |
| Arthralgia | 5.9 | 6.3 |
| Hypertension | 3.9 | 5.3 |
Pædiatri
Tabel 3 opsummerer de bivirkninger, der forekommer med frekvensen højere end 5% i en klinisk undersøgelse hos børn og unge med type 1 -diabetes behandlet med Apidra (n = 277) eller insulin lispro (n = 295).
Tabel 3: Behandling –Engent bivirkning hos børn og unge med type 1 -diabetes (bivirkninger med frekvens ≥ 5%)
| Apidra % (n = 277) | Lispro % (n = 295) | |
| Nasopharyngitis | 9.0 | 9.5 |
| Øvre luftvej infection | 8.3 | 10.8 |
| Hovedpine | 6.9 | 11.2 |
| Hypoglykæmisk anfald | 6.1 | 4.7 |
Alvorlig symptomatisk hypoglykæmi
Hypoglykæmi is the most commonly observed adverse reaction in patients using insulin including Apidra [See Advarsler og FORHOLDSREGLER ]. The rates og incidence of severe symptomatic hypoglycemia defined as hypoglycemia requiring intervention from a third party were comparable for all treatment regimens (see Table 4). In the phase 3 clinical trial children og adolescents with type 1 diabetes had a higher incidence of severe symptomatic hypoglycemia in the two treatment groups compared to adults with type 1 diabetes. (see Table 4) [See Kliniske studier ].
Tabel 4: Alvorlig symptomatisk hypoglykæmi*
| Type 1 Diabetes Voksne 12 uger med insulin glargine | Type 1 Diabetes Voksne 26 uger med insulin glargine | Type 2 Diabetes Voksne 26 uger med NPH human insulin | Type 1 diabetes pædiatri 26 uger | ||||||
| Apidra Pre-meal | Apidra Post-meal | Regelmæssig humant insulin | Apidra | Insulin Lispro | Apidra | Regelmæssig humant insulin | Apidra | Insulin Lispro | |
| Begivenheder pr. Måned pr. Patient | 0.05 | 0.05 | 0.13 | 0.02 | 0.02 | 0.00 | 0.00 | 0.09 | 0.08 |
| Procent af patienterne (n/total N) | 8,4% (24/286) | 8,4% (25/296) | 10,1% (28/278) | 4,8% (16/339) | 4,0% (13/333) | 1,4% (6/416) | 1,2% (5/420) | 16,2% (45/277) | 19,3% (57/295) |
| * Alvorlig symptomatisk hypoglykæmi defineret som en hypoglykæmisk begivenhed, der kræver hjælp fra en anden person, der opfyldte et af følgende kriterier: Begivenheden var forbundet med en helblod, der henviste til blodglukose <36mg/dL or the event was associated with prompt recovery after oral carbohydrate intravenous glucose or glucagon administration. |
Insulininitiering og intensivering af glukosekontrol
Intensivering eller hurtig forbedring af glukosekontrol er blevet forbundet med en forbigående reversibel oftalmologisk brydningsforstyrrelse forværring af diabetisk retinopati og akut smertefuld perifer neuropati. Imidlertid reducerer langvarig glykæmisk kontrol risikoen for diabetisk retinopati og neuropati.
Lipodystrofi
Langvarig anvendelse af insulin inklusive Apidra kan forårsage lipodystrofi på stedet for gentagne insulininjektioner eller infusion. Lipodystrofi inkluderer lipohypertrofi (fortykning af fedtvæv) og lipoatrofi (udtynding af fedtvæv) og kan påvirke insulinabsorptionen. Drej insulininjektions- eller infusionssteder inden for den samme region for at reducere risikoen for lipodystrofi. [Se Dosering og administration ].
Vægtøgning
Vægtøgning can occur with insulin therapy including Apidra og has been attributed to the anabolic effects of insulin og the decrease in glucosuria.
Perifert ødem
Insulin inklusive Apidra kan forårsage natriumretention og ødemer, især hvis tidligere dårlig metabolisk kontrol forbedres ved intensiveret insulinbehandling.
Bivirkninger med kontinuerlig subkutan insulininfusion (CSII)
I en 12-ugers randomiseret undersøgelse hos patienter med type 1-diabetes (n = 59) var antallet af kateter-okklusioner og infusionsstedreaktioner ens for Apidra og insulin-aspart-behandlede patienter (tabel 5).
Tabel 5: Kateter okklusioner og reaktioner på infusionsstedet.
| 40% | Apidra (n=29) | Insulin Aspart (n = 30) |
| Kateter okklusioner/måned | 0.08 | 0.15 |
| Reaktioner på infusionsstedet | 10,3% (3/29) | 13,3% (4/30) |
Allergiske reaktioner
Lokal allergi
Som med enhver insulinterapipatienter, der tager Apidra, kan det opleve hævelse i rødme eller kløe på injektionsstedet. Disse mindre reaktioner løser normalt om et par dage til et par uger, men i nogle gange kan det kræve seponering af Apidra. I nogle tilfælde kan disse reaktioner være relateret til andre faktorer end insulin, såsom irritanter i et hudrensningsmiddel eller dårlig injektionsteknik.
Systemisk allergi
Alvorlig livstruende generaliseret allergi inklusive anafylaksi kan forekomme med ethvert insulin inklusive Apidra. Generaliseret allergi mod insulin kan forårsage hele kropsudslæt (inklusive kløe) dyspnø vejrtrækning hypotension takykardi eller diaphorese.
I kontrollerede kliniske forsøg op til 12 måneders varighedspotentiale systemiske allergiske reaktioner blev rapporteret hos 79 af 1833 patienter (4,3%), der modtog Apidra og 58 af 1524 patienter (3,8%), der modtog komparatoren kortvirkende insuliner. Under disse forsøg blev behandling med Apidra permanent afbrudt hos 1 af 1833 patienter på grund af en potentiel systemisk allergisk reaktion.
Der er rapporteret om lokaliserede reaktioner og generaliserede myalgier ved anvendelse af metacresol, som er en excipient af Apidra.
Antistofproduktion
I en undersøgelse hos patienter med type 1-diabetes (n = 333) forblev koncentrationerne af insulinantistoffer, der reagerer med både humant insulin og insulinglulisin (tværreaktive insulinantistoffer) nær baseline i de første 6 måneder af undersøgelsen hos patienterne, der blev behandlet med Apidra. Et fald i antistofkoncentration blev observeret i løbet af de følgende 6 måneder af undersøgelsen. I en undersøgelse hos patienter med type 2-diabetes (n = 411) blev der observeret en lignende stigning i tværreaktivt insulinkoncentration hos patienterne behandlet med Apidra og hos patienterne behandlet med humant insulin i de første 9 måneder af undersøgelsen. Derefter faldt koncentrationen af antistoffer hos Apidra -patienterne og forblev stabile hos de humane insulinpatienter. Der var ingen sammenhæng mellem tværreaktivt insulinantistofkoncentration og ændringer i HbA1c-insulindoser eller forekomst af hypoglykæmi. Den kliniske betydning af disse antistoffer er ikke kendt.
Apidra did not elicit a significant antibody response in a study of children og adolescents with type 1 diabetes.
Oplevelse af postmarketing
Følgende bivirkninger er blevet identificeret under anvendelse af Apidra efter godkendelse.
Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt at estimere pålideligt deres frekvens eller etablere et årsagsforhold til eksponering for lægemidler.
Der er rapporteret om medicinfejl, hvor andre insuliner, der er særligt langtidsvirkende insuliner, ved et uheld er blevet administreret i stedet for Apidra [se Patientinformation ].
Lægemiddelinteraktioner for Apidra
Et antal lægemidler påvirker glukosemetabolismen og kan kræve insulindosisjustering og især tæt overvågning.
Lægemidler, der kan øge den blodsukkersænkende virkning af insuliner, herunder Apidra, og derfor øger risikoen for hypoglykæmi inkluderer orale antidiabetiske produkter Pramlintid Ace-hæmmere Disopyramid fibrater fluoxetin monoaminoxidaseinhibitorer Propoxyphene pentoxifylline salicylater somatostatinanaloger og sulfonamidase antibiotik.
Lægemidler, der kan reducere den blodglukosesænkende virkning af Apidra, inkluderer kortikosteroider niacin danazol diuretiske sympatomimetiske midler (f.eks. Epinephrin albuterol terbutalin) glucagon isoniazid phenothiazinderivativer somatropin thyroid hormones estrogens progestogens (e.G. i orale kontroverserende) beskyttelse Inhibitorer og atypiske antipsykotika.
Betablokkere klonidin lithiumsalte og alkohol kan enten øge eller mindske den blodglucosesænkende virkning af insulin.
Pentamidin kan forårsage hypoglykæmi, som undertiden kan følges af hyperglykæmi.
Tegnene på hypoglykæmi kan reduceres eller fraværende hos patienter, der tager anti-adrenerge lægemidler, såsom betablokkere, klonidin guanethidin og reserpin.
Advarsler for Apidra
Inkluderet som en del af FORHOLDSREGLER afsnit.
Forholdsregler for Apidra
Doseringsjustering og overvågning
Glukoseovervågning er vigtig for patienter, der får insulinbehandling. Ændringer i et insulinregime bør foretages forsigtigt og kun under medicinsk tilsyn. Ændringer i insulinstyrkeproducenttype eller administrationsmetode kan resultere i behovet for en ændring i insulindosis. Samtidig oral antidiabetisk behandling kan muligvis justeres.
Som med alle insulinpræparater kan tidsforløbet for Apidra variere i forskellige individer eller på forskellige tidspunkter i det samme individ og er afhængig af mange tilstande, herunder stedet for injektion af lokal blodforsyning eller lokal temperatur. Patienter, der ændrer deres niveau af fysisk aktivitet eller måltidsplan, kan kræve justering af insulindoseringer.
Hypoglykæmi
Hypoglykæmi is the most common adverse reaction of insulin therapy including Apidra. The risk of hypoglycemia increases with tighter glycemic control. Patients must be educated to recognize og manage hypoglycemia. Severe hypoglycemia may lead to unconsciousness og/or convulsions og may result in temporary or permanent impairment of brain function or death. Severe hypoglycemia requiring the assistance of another person og/or parenteral glucose infusion or glucagon administration has been observed in clinical trials with insulin including trials with Apidra.
Tidspunktet for hypoglykæmi afspejler normalt tids-handlingsprofilen for de administrerede insulinformuleringer. Andre faktorer, såsom ændringer i fødeindtag (f.eks. Mængde af mad eller timing af måltider) Injektionsstedets træning og samtidig medicin kan også ændre risikoen for hypoglykæmi [Se Lægemiddelinteraktioner ].
Som med alle insuliner bruger forsigtighed hos patienter med hypoglykæmi uvidende og hos patienter, der kan være disponeret for hypoglykæmi (f.eks. Den pædiatriske population og patienter, der hurtigt eller har uberegnelig fødeindtag). Patientens evne til at koncentrere sig og reagere kan være nedsat som et resultat af hypoglykæmi. Dette kan udgøre en risiko i situationer, hvor disse evner er især vigtige, såsom at køre eller betjene andre maskiner.
Hurtige ændringer i serumglukoseniveauer kan inducere symptomer, der ligner hypoglykæmi hos personer med diabetes uanset glukoseværdien. Tidlige advarselssymptomer på hypoglykæmi kan være forskellige eller mindre udtalt under visse betingelser, såsom langvarig diabetes diabetisk nervesygdom brug af medicin såsom betablokkere [se Lægemiddelinteraktioner ] eller intensiveret diabetes kontrol. Disse situationer kan resultere i svær hypoglykæmi (og muligvis tab af bevidsthed) inden patientens opmærksomhed om hypoglykæmi.
Intravenøst administreret insulin har en hurtigere indtræden af virkning end subkutant administreret insulin, der kræver tættere overvågning for hypoglykæmi.
Overfølsomhed og allergiske reaktioner
Alvorlig livstruende generaliseret allergi inklusive anafylaksi kan forekomme med insulinprodukter inklusive Apidra [se Bivirkninger ].
Hypokalæmi
Alle insulinprodukter inklusive Apidra forårsager et skift i kalium fra det ekstracellulære til det intracellulære rum, der muligvis fører til hypokalæmi. Ubehandlet hypokalæmi kan forårsage respiratorisk lammelse af ventrikulær arytmi og død. Brug forsigtighed hos patienter, der kan være i fare for hypokalæmi (f.eks. Patienter, der bruger kaliumsænkende medicin, patienter, der tager medicin følsomme over for serumkaliumkoncentrationer). Overvåg glukose og kalium ofte, når Apidra administreres intravenøst.
Nyren for nyre eller lever
Hyppig reduktion af glukoseovervågning og insulindosis kan være påkrævet hos patienter med nyre- eller leversnedsættelse [se Klinisk farmakologi ].
Blanding af insuliner
Apidra for subcutaneous injection should not be mixed with insulin preparations other than NPH insulin. If Apidra is mixed with NPH insulin Apidra should be drawn into the syringe first. Injection should occur immediately after mixing.
Bland ikke Apidra med andre insuliner til intravenøs administration eller til brug i en kontinuerlig subkutan infusionspumpe.
Apidra for intravenous administration should not be diluted with solutions other than 0.9% sodium chloride (normal saline). The efficacy og safety of mixing Apidra with diluents or other insulins for use in external subcutaneous infusion pumps have not been established.
Subkutane insulininfusionspumper
Når det bruges i en ekstern insulinpumpe til subkutan infusion, bør Apidra ikke fortyndes eller blandes med nogen anden insulin. Apidra i reservoiret skal ændres mindst hver 48 time. Apidra bør ikke udsættes for temperaturer over 98,6 ° F (37 ° C).
Fejl i insulinpumpen eller infusionssættet eller håndteringsfejl eller insulinnedbrydning kan hurtigt føre til hyperglykæmi ketose og diabetisk ketoacidose. Hurtig identifikation og korrektion af årsagen til hyperglykæmi eller ketose eller diabetisk ketoacidose er nødvendig. Midlertidige subkutane injektioner med Apidra kan være påkrævet. Patienter, der bruger kontinuerlig subkutan insulininfusionspumpebehandling, skal trænes til at administrere insulin ved injektion og have alternativ insulinbehandling tilgængelig. [Se Dosering og administration Hvor leveret / Opbevaring og håndtering og Patientinformation ].
Intravenøs administration
Når Apidra administreres intravenøst glukose- og kaliumniveauer skal overvåges nøje for at undgå potentielt dødelig hypoglykæmi og hypokalæmi.
Bland ikke Apidra med andre insuliner til intravenøs administration. Apidra kan kun fortyndes i normal saltopløsning.
Lægemiddelinteraktioner
Nogle medicin kan ændre insulinkrav og risikoen for hypoglykæmi eller hyperglykæmi [se Lægemiddelinteraktioner ].
Fluidretention og hjertesvigt med samtidig brug af PPAR-gamma-agonister
Thiazolidinediones (TZDS), som er peroxisomproliferator-aktiveret receptor (PPAR) gamma-agonister, kan forårsage dosisrelateret væskeretention, især når det bruges i kombination med insulin. Fluidretention kan føre til eller forværre hjertesvigt. Patienter behandlet med insulin inklusive Apidra og en PPAR-gamma-agonist skal observeres for tegn og symptomer på hjertesvigt. Hvis hjertesvigt udvikler, skal det styres i henhold til de nuværende standarder for pleje og seponering eller dosisreduktion af PPAR-gamma-agonisten skal overvejes.
Oplysninger om patientrådgivning
Se FDA-godkendt Patientmærkning .
Instruktioner til alle patienter
Patienter skal instrueres i selvstyringsprocedurer, herunder glukoseovervågning korrekt injektionsteknik og håndtering af hypoglykæmi og hyperglykæmi. Patienter skal instrueres om håndtering af specielle situationer, såsom intercurrent -tilstande (sygdomsstress eller følelsesmæssige forstyrrelser), en utilstrækkelig eller sprunget insulindosis utilsigtet administration af en øget insulindosis utilstrækkeligt fødeindtag og sprunget måltider. Henvis patienter til Apidra -patientinformationsinformation for yderligere information.
Kvinder med diabetes bør rådes til at informere deres læge, hvis de er gravide eller overvejer graviditet.
Tilfældige mix-ups mellem Apidra og andre insuliner, der er rapporteret om særlig langtidsvirkende insuliner. For at undgå medicinfejl mellem Apidra og andre insuliner skal patienter instrueres i altid at kontrollere insulinetiketten før hver injektion.
For patienter, der bruger kontinuerlige subkutane insulinpumper
Patienter, der bruger ekstern pumpeinfusionsterapi, skal trænes korrekt.
Følgende insulinpumper † er blevet anvendt i Apidra kliniske forsøg udført af Sanofiaventis Producenten af Apidra:
- Disetronic® H-Tron® Plus V100 og D-Tron® med disetroniske katetre (Rapid ™ Rapid C ™ Rapid D ™ og Tender ™)
- Minimed® Models 506 507 507c og 508 med minimerede katetre (SOF-set Ultimate QR ™ og Quick-Set ™).
Før du bruger en anden insulinpumpe med Apidra, skal du læse pumpemærket for at sikre, at pumpen er blevet evalueret med Apidra.
For at minimere insulinnedbrydningsinfusionssæt til okklusion og tab af konserveringsmiddel (metacresol) skal infusionssættet (reservoirrør og kateter) og Apidra i reservoiret udskiftes mindst hver 48 time og et nyt infusionssted skal vælges. Temperaturen på insulinet kan overstige omgivelsestemperaturen, når pumpehusdækslet rør eller sportssag udsættes for sollys eller strålende varme. Insulin udsat for temperaturer, der er højere end 98,6 ° F (37 ° C), skal kasseres. Infusionssteder, der er erytematiske kløe eller fortykkede, skal rapporteres til sundhedspersonalet og et nyt sted valgt, fordi fortsat infusion kan øge hudreaktionen eller ændre absorptionen af Apidra.
Pumpe- eller infusionssæt funktionsfejl eller håndteringsfejl eller insulinnedbrydning kan føre til hurtig hyperglykæmi og ketose og diabetisk ketoacidose. Dette er især relevant for hurtigvirkende insulinanaloger, der hurtigere absorberes gennem huden og har en kortere handlingsvarighed. Hurtig identifikation og korrektion af årsagen til hyperglykæmi eller ketose eller diabetisk ketoacidose er nødvendig. Problemer inkluderer pumpefejlinfusionssæt okklusion lækage afbrydelse eller kinking håndteringsfejl og nedbrudt insulin. Mindre almindeligt hypoglykæmi fra pumpefejl kan forekomme. Hvis disse problemer ikke straks korrigeres, skal patienter genoptage terapi med subkutan insulininjektion og kontakte deres sundhedspersonale. Patienter, der administrerer Apidra ved kontinuerlig subkutan infusion, skal have et alternativt insulinleveringssystem i tilfælde af pumpesystemfejl. [Se Dosering og administration Advarsler og FORHOLDSREGLER og Hvor leveret / Opbevaring og håndtering ].
Ikke -klinisk toksikologi
Karcinogenese mutagenese nedskrivning af fertilitet
Standard 2-årige carcinogenicitetsundersøgelser hos dyr er ikke blevet udført. I Sprague Dawley-rotter blev der udført en 12-måneders gentagelsesdosis-toksicitetsundersøgelse med insulinglulisin ved subkutane doser på 2,5 5 20 eller 50 enheder/kg to gange dagligt (dosis, hvilket resulterede i en eksponering 1 2 8 og 20 gange den gennemsnitlige humane dosis baseret på kropsoverfladeareal-sammenligning).
Der var en ikke-dosis afhængig højere forekomst af tumorer i brystkirtler hos hunrotter, der blev administreret insulinglulisin sammenlignet med ubehandlede kontroller. Forekomsten af brysttumorer til insulin glulisin og regelmæssig humant insulin var ens. Relevansen af disse fund for mennesker er ikke kendt. Insulin glulisin var ikke mutagen i følgende test: Ames -test In vitro Pattedyrs kromosomafvigelse -test i V79 kinesiske hamsterceller og in vivo pattedyr erytrocyt mikronukleus -test hos rotter.
Bivirkninger af jernsulfattabletter
I fertilitetsundersøgelser hos mandlige og kvindelige rotter ved subkutane doser op til 10 enheder/kg en gang dagligt (dosis, hvilket resulterede i en eksponering 2 gange den gennemsnitlige humane dosis baseret på kropsoverfladeareal -sammenligning) blev der ikke observeret klare bivirkninger på mandlig og kvindelig fertilitet eller generel reproduktiv ydeevne af dyr.
Brug i specifikke populationer
Graviditet
Graviditet Category C
Reproduktions- og teratologiske undersøgelser er blevet udført med insulin -glulisin hos rotter og kaniner ved anvendelse af almindeligt humant insulin som komparator. Insulin-glulisin blev givet til kvindelige rotter under hele graviditeten i subkutane doser op til 10 enheder/kg en gang dagligt (dosis, hvilket resulterede i en eksponering 2 gange den gennemsnitlige humane dosis baseret på kropsoverfladeareal-sammenligning) og havde ikke nogen bemærkelsesværdige toksiske virkninger på embryo-føtaludvikling.
Insulin -glulisin blev givet til kvindelige kaniner under hele graviditeten i subkutane doser op til 1,5 enheder/kg/dag (dosis, hvilket resulterede i en eksponering 0,5 gange den gennemsnitlige humane dosis baseret på kropsoverfladeareal -sammenligning). Bivirkninger på embryo-føtaludvikling blev kun set ved mødre-giftige dosisniveauer, der inducerede hypoglykæmi. Forøget forekomst af tab efter implantation og skeletdefekter blev observeret i et dosisniveau på 1,5 enheder/kg en gang dagligt (dosis, hvilket resulterede i en eksponering 0,5 gange den gennemsnitlige humane dosis baseret på kropsoverfladeareals sammenligning), der også forårsagede dødelighed i dæmninger. En lille øget forekomst af tab efter implantation blev set ved det næste lavere dosisniveau på 0,5 enheder/kg en gang dagligt (dosis, hvilket resulterede i en eksponering 0,2 gange den gennemsnitlige humane dosis baseret på kropsoverfladeareal-sammenligning), som også var forbundet med svær hypoglykæmi, men der var ingen defekter. Ingen effekter blev observeret hos kaniner i en dosis på 0,25 enheder/kg en gang dagligt (dosis, hvilket resulterede i en eksponering 0,1 gange den gennemsnitlige humane dosis baseret på kropsoverfladeareal -sammenligning). Virkningerne af insulinglulisin adskiller sig ikke fra dem, der blev observeret med subkutan regelmæssig human insulin i de samme doser og blev tilskrevet sekundære virkninger af moderlig hypoglykæmi.
Der er ingen velkontrollerede kliniske undersøgelser af brugen af Apidra hos gravide kvinder. Fordi dyreproduktionsundersøgelser ikke altid er forudsigelige for menneskelig respons, skal dette lægemiddel kun bruges under graviditet, hvis den potentielle fordel retfærdiggør den potentielle risiko for fosteret. Det er vigtigt for patienter med diabetes eller en historie med svangerskabsdiabetes at opretholde god metabolisk kontrol før undfangelse og under hele graviditeten. Insulinbehovet kan falde i løbet af første trimester, der generelt stiger i løbet af den anden og tredje trimestere og falder hurtigt efter fødslen. Omhyggelig overvågning af glukosekontrol er vigtig hos disse patienter.
Sygeplejerske mødre
Det er ukendt, om insulinglulisin udskilles i human mælk. Fordi mange lægemidler udskilles i menneskelig mælkens forsigtighed bør udøves, når Apidra administreres til en sygeplejekvinde. Brug af Apidra er kompatibel med amning, men kvinder med diabetes, der ammes, kan kræve justeringer af deres insulindoser.
Pædiatrisk brug
Sikkerheden og effektiviteten af subkutane injektioner af Apidra er blevet etableret hos pædiatriske patienter (alder 4 til 17 år) med type 1 -diabetes [se Kliniske studier ]. Apidra has not been studied in pediatric patients with type 1 diabetes younger than 4 years of age og in pediatric patients with type 2 diabetes .
Som hos voksne skal doseringen af Apidra være individualiseret hos pædiatriske patienter baseret på metaboliske behov og hyppig overvågning af blodsukker.
Geriatrisk brug
I kliniske forsøg (N = 2408) blev Apidra administreret til 147 patienter ≥ 65 år og 27 patienter ≥ 75 år. Størstedelen af denne lille undergruppe af ældre patienter havde type 2 -diabetes. Ændringen i HBA1C -værdier og hypoglykæmifrekvenser var ikke forskellige efter alder. Ikke desto mindre skal der udvises forsigtighed, når Apidra administreres til geriatriske patienter.
Overdoseringsoplysninger til Apidra
Overskydende insulin kan forårsage hypoglykæmi og især når de får intravenøst hypokalæmi. Mild episoder af hypoglykæmi kan normalt behandles med oral glukose.
Justeringer i lægemiddeldoseringsmåltidsmønstre eller træning kan være nødvendige. Mere alvorlige episoder med hypoglykæmi med koma -anfald eller neurologisk svækkelse kan behandles med intramuskulær/subkutan glukagon eller koncentreret intravenøs glukose. Vedvarende kulhydratindtagelse og observation kan være nødvendigt, fordi hypoglykæmi kan gentage sig efter tilsyneladende klinisk bedring. Hypokalæmi skal korrigeres korrekt.
Kontraindikationer for Apidra
Apidra is contraindicated:
- Under episoder med hypoglykæmi
- Hos patienter, der er overfølsomme over for Apidra eller for nogen af dets eksipendier, når de bruges hos patienter med kendt overfølsomhed over for Apidra eller dets excipienser, kan patienter udvikle lokaliserede eller generelle overfølsomhedsreaktioner [se Bivirkninger ].
Klinisk farmakologi for Apidra
Handlingsmekanisme
Regulering af glukosemetabolisme er den primære aktivitet af insuliner og insulinanaloger inklusive insulinglulisin. Insuliner sænker blodsukkeret ved at stimulere perifer glukoseoptagelse ved knoglemuskel og fedt og ved at hæmme leverglukoseproduktionen. Insuliner hæmmer lipolyse og proteolyse og forbedrer proteinsyntesen.
Apidra og almindeligt humant insulin er udstyret med glukose, der sænker aktiviteterne og af almindeligt humant insulin, når de administreres af den intravenøse rute. Efter subkutan administration er effekten af Apidra hurtigere i begyndelsen og af kortere varighed sammenlignet med almindeligt humant insulin. [Se Farmakodynamik ].
Farmakodynamik
Undersøgelser hos raske frivillige og patienter med diabetes demonstrerede, at Apidra har en hurtigere indtræden af handling og en kortere aktivitetsvarighed end almindeligt humant insulin, når de gives subkutant.
I en undersøgelse hos patienter med type 1-diabetes (n = 20) blev de glukosesænkende profiler af Apidra og almindeligt humant insulin vurderet på forskellige tidspunkter i forhold til et standardmåltid i en dosis på 0,15 enheder/kg. (Figur 1.)
Den maksimale blodglukoseudflugt (ΔGlumax; baseline subtraherede glukosekoncentration) for Apidra injiceret 2 minutter før et måltid var 65 mg/dL sammenlignet med 64 mg/dL for almindeligt humant insulin injiceret 30 minutter før et måltid (se figur 1A) og 84 mg/dL for regelmæssig human insulin injiceret 2 minutter før et måltid (se figur 1B). Den maksimale blodglukoseudflugt til Apidra injiceret 15 minutter efter starten af et måltid var 85 mg/dL sammenlignet med 84 mg/dL for almindeligt humant insulin injiceret 2 minutter før et måltid (se figur 1C).
Figur 1. Seriel gennemsnitlig blodglukose opsamlet op til 6 timer efter en enkelt dosis af Apidra og almindeligt humant insulin. Apidra givet 2 minutter (Apidra -Pre) inden starten af et måltid sammenlignet med almindeligt humant insulin givet 30 minutter (almindelig -30 minutter) før starten af måltidet (figur 1A) og sammenlignet med almindeligt humant insulin (almindelig -Pre) givet 2 minutter før et måltid (figur 1B). Apidra givet 15 minutter (Apidra -post) efter start af et måltid sammenlignet med almindeligt humant insulin (almindelig -Pre) givet 2 minutter før et måltid (figur 1C). På X-Axis Zero (0) er starten på et 15-minutters måltid.
Figur 1a
 |
Figur 1b
 |
Figur c
 |
I en randomiseret open-label tovejs crossover-undersøgelse modtog 16 raske mandlige forsøgspersoner en intravenøs infusion af Apidra eller regelmæssigt humant insulin med saltvandsmiddel med en hastighed på 0,8 milliunits/kg/min i to timer. Infusion af den samme dosis af Apidra eller almindeligt humant insulin produceret ækvivalent glukose bortskaffelse i stabil tilstand.
Farmakokinetik
Absorption og biotilgængelighed
Farmakokinetiske profiler hos raske frivillige og patienter med diabetes (type 1 eller type 2) demonstrerede, at absorption af insulinglulisin var hurtigere end for almindeligt humant insulin.
I en undersøgelse hos patienter med type 1 -diabetes (n = 20) efter subkutan administration af 0,15 enheder/kg var mediantiden til maksimal koncentration (Tmax) 60 minutter (interval 40 til 120 minutter) og topkoncentrationen (Cmax) var 83 mikrounits/ml (interval 40 til 131 mikrounitter/ml) for insulin glulisin sammenlignet til en median tmax af 1200 minutter (interval 40 til 239 minutter) og en Cmax på 50 mikrounitter/ml (område 35 til 71 mikrounitter/ml) for almindeligt humant insulin. (Figur 2)
Figur 2. Farmakokinetiske profiler af insulinglulisin og regelmæssig human insulin hos patienter med type 1 -diabetes efter en dosis på 0,15 enheder/kg.
Figur 2
 |
Insulinglulisin og regelmæssig humant insulin blev administreret subkutant i en dosis på 0,2 enheder/kg i en euglycemisk klemmeundersøgelse hos patienter med type 2 -diabetes (n = 24) og et kropsmasseindeks (BMI) mellem 20 og 36 kg/m². Mediantiden til maksimal koncentration (Tmax) var 100 minutter (rækkevidde 40 til 120 minutter), og median topkoncentration (Cmax) var 84 mikrounits/ml (område 53 til 165 mikrounitter/ml) for insulin glulisin sammenlignet med en median Tmax på 240 minutter (interval 80 til 360 minutter) og en median Cmax på 41 microunits/ml (område 33 til 61 Mikounits/ml) til almindelig humant insulin. (Figur 3.)
Figur 3 . Farmakokinetiske profiler af insulinglulisin og regelmæssig human insulin hos patienter med type 2 -diabetes efter en subkutan dosis på 0,2 enheder/kg.
Figur 3
 |
Da Apidra blev injiceret subkutant i forskellige områder af kroppen, var tidskoncentrationsprofilerne ens. Den absolutte biotilgængelighed af insulinglulisin efter subkutan administration er ca. 70% uanset injektionsområde (maven 73% deltoid 71% lår 68%).
I en klinisk undersøgelse hos raske frivillige (n = 32) var den totale insulinglulisin -biotilgængelighed ens efter subkutan injektion af insulinglulisin og NPH -insulin (forblandet i sprøjten) og efter separate samtidige subkutane injektioner. Der var 27% dæmpning af den maksimale koncentration (Cmax) af Apidra efter forblanding; Tiden til maksimal koncentration (Tmax) blev imidlertid ikke påvirket. Ingen data er tilgængelige om at blande Apidra med andre insulinpræparater end NPH -insulin. [Se Kliniske studier ].
Distribution og eliminering
Fordelingen og eliminering af insulinglulisin og regelmæssig human insulin efter intravenøs administration er ens med mængder af fordeling på henholdsvis 13 og 21 L og halveringstider på 13 og 17 minutter. Efter subkutan administration elimineres insulin glulisin hurtigere end almindeligt humant insulin med en tilsyneladende halveringstid på 42 minutter sammenlignet med 86 minutter.
Klinisk farmakologi In Specific Populations
Pædiatriske patienter
De farmakokinetiske og farmakodynamiske egenskaber ved Apidra og regelmæssigt humant insulin blev vurderet i en undersøgelse udført hos børn 7 til 11 år gamle (n = 10) og unge 12 til 16 år gamle (n = 10) med type 1 -diabetes. De relative forskelle i farmakokinetik og farmakodynamik mellem Apidra og almindeligt humant insulin hos disse patienter med type 1 -diabetes svarede til dem hos raske voksne personer og voksne med type 1 -diabetes.
Race
En undersøgelse i 24 raske kaukasiere og japanske forsøgspersoner sammenlignede farmakokinetikken og farmakodynamikken efter subkutan injektion af insulin glulisin insulin lispro og almindelig humant insulin. Med subkutan injektion af insulinglulisin-japanske forsøgspersoner havde en større indledende eksponering (33%) for forholdet mellem AUC (0-1H) og AUC (0-klampenden) end kaukasiere (21%), skønt de samlede eksponeringer var ens. Der var lignende fund med insulin lispro og almindelig humant insulin.
Fedme
Insulinglulisin og regelmæssig humant insulin blev indgivet subkutant ved en dosis på 0,3 enheder/kg i en euglycemisk klemmeundersøgelse i overvægtige ikke-diabetiske personer (n = 18) med et kropsmasseindeks (BMI) mellem 30 og 40 kg/m². Mediantiden til maksimal koncentration (Tmax) var 85 minutter (område 49 til 150 minutter), og median topkoncentration (CMAX) var 192 mikrounits/ml (interval 98 til 380 mikrounitter/ml) for insulin glulisin sammenlignet med en median Tmax på 150 minutter (interval 90 til 240 minutter) og en median cmax på 86 mikrounitter/ml (interval 43 til 170 minutter) Mikounits/ml) til almindelig humant insulin.
Den hurtigere indtræden af handling og kortere varighed af aktiviteten af Apidra og insulin Lispro sammenlignet med almindeligt humant insulin blev opretholdt i en overvægtig ikke-diabetisk population (n = 18). (Figur 4.)
Figur 4 . Glukoseinfusionshastigheder (GIR) i en euglycemisk klemmeundersøgelse efter subkutan injektion af 0,3 enheder/kg Apidra -insulin lispro eller almindelig humant insulin i en overvægtig befolkning.
Figur 4
 |
Nedskærmning af nyren
Undersøgelser med humant insulin har vist øgede cirkulerende niveauer af insulin hos patienter med nyresvigt. I en undersøgelse udført i 24 ikke-diabetiske personer med normal nyrefunktion (CLCR> 80 ml/min) Moderat nedsat nyrefunktion (30-50 ml/min) og alvorlig nedsat nyrefunktion <30 mL/min) the subjects with moderate og severe renal impairment had increased exposure to insulin glulisine by 29% to 40% og reduced clearance of insulin glulisine by 20% to 25% compared to subjects with normal renal function. [See Advarsler og FORHOLDSREGLER ].
Leverskrivning i leveren
Effekten af leverindtægter på farmakokinetikken og farmakodynamikken i Apidra er ikke undersøgt. Nogle undersøgelser med humant insulin har vist øgede cirkulerende niveauer af insulin hos patienter med leversvigt. [Se Advarsler og FORHOLDSREGLER ].
Køn
Effekten af køn på farmakokinetikken og farmakodynamikken i Apidra er ikke undersøgt.
Graviditet
Effekten af graviditet på farmakokinetikken og farmakodynamikken i Apidra er ikke undersøgt.
Rygning
Effekten af rygning på farmakokinetikken og farmakodynamikken i Apidra er ikke undersøgt.
Kliniske studier
Sikkerheden og effektiviteten af Apidra blev undersøgt hos voksne patienter med type 1 og type 2 -diabetes (n = 1833) og hos børn og unge patienter (4 til 17 år) med type 1 -diabetes (n = 572). Den primære effektivitetsparameter i disse forsøg var glykæmisk kontrol vurderet under anvendelse af glycated hæmoglobin (GHB rapporteret som HBA1C -ækvivalent).
Type 1 diabetes-voksne
En 26-ugers randomiseret open-label aktiv-kontrolleret ikke-mindrevinitetsundersøgelse blev udført hos patienter med type 1-diabetes for at vurdere sikkerheden og effektiviteten af Apidra (n = 339) sammenlignet med insulin lispro (n = 333), når de blev administreret subkutant inden for 15 minutter før et måltid. Insulin -glargin blev administreret en gang dagligt om aftenen som basalinsulin. Der var en 4-ugers run-in-periode med insulin lispro og insulin glargine før randomisering. De fleste patienter var kaukasiske (97%). Femogtyve procent af patienterne var mænd. Middelalderen var 39 år (område 18 til 74 år). Glykæmisk kontrol af antallet af daglige kortvirkende insulininjektioner og de samlede daglige doser af Apidra og insulin Lispro var ens i de to behandlingsgrupper (tabel 6).
Tabel 6: Type 1 Diabetes Mellitus - voksne
| Behandling af behandlingsvarighed i kombination med: | 26 uger insulin glargine | |
| Apidra | Insulin Lispro | |
| Glycated hæmoglobin (GHB)* (%) | ||
| Antal patienter | 331 | 322 |
| Baseline mean | 7.6 | 7.6 |
| Adjusted mean change from baseline | -0.1 | -0.1 |
| Treatment difference: Apidra - Insulin Lispro | 0.0 | |
| 95% CI for treatment difference | (-0,1; 0,1) | |
| Basal insulindosis (enheder/dag) | ||
| Baseline mean | 24 | 24 |
| Adjusted mean change from baseline | 0 | 2 |
| Kortvirkende insulindosis (enheder/dag) | ||
| Baseline mean | 30 | 31 |
| Adjusted mean change from baseline | -1 | -1 |
| Gennemsnitligt antal kortvirkende insulininjektioner pr. Dag | 3 | 3 |
| Kropsvægt (kg) | ||
| Baseline mean | 73.9 | 74.1 |
| Mean change from baseline | 0.6 | 0.3 |
| *GHB rapporteret som HBA1C -ækvivalent |
Type 2 diabetes-voksne
En 26-ugers randomiseret open-label aktiv-kontrolleret ikke-mindrevinitetsundersøgelse blev udført hos insulinbehandlede patienter med type 2-diabetes for at vurdere sikkerheden og effektiviteten af Apidra (n = 435) givet inden for 15 minutter før et måltid sammenlignet med almindeligt humant insulin (n = 441) administreret 30 til 45 minutter før et måltid. NPH humant insulin blev givet to gange om dagen som basal insulin. Alle patienter deltog i en 4-ugers run-in-periode med regelmæssig human insulin og NPH humant insulin. Femogfirs procent af patienterne var kaukasiske og 11% var sorte. Middelalderen var 58 år (område 26 til 84 år). Det gennemsnitlige kropsmasseindeks (BMI) var 34,6 kg/m². Ved randomisering tog 58% af patienterne et oralt antidiabetisk middel. Disse patienter blev bedt om at fortsætte brugen af deres orale antidiabetiske middel i den samme dosis under hele forsøget. Størstedelen af patienterne (79%) blandede deres kortvirkende insulin med NPH humant insulin umiddelbart før injektion. Reduktionerne fra baseline i GHB var ens mellem de 2 behandlingsgrupper (se tabel 7). Ingen forskelle mellem Apidra og almindelige humane insulingrupper blev set i antallet af daglige kortvirkende insulininjektioner eller basale eller kortvirkende insulindoser. (Se tabel 7.)
Tabel 7: Type 2 Diabetes Mellitus - voksne
| Behandling af behandlingsvarighed i kombination med: | 26 uger NPH humant insulin | |
| Apidra | Regelmæssig humant insulin | |
| Glycated hæmoglobin (GHB)* (%) | ||
| Antal patienter | 404 | 403 |
| Baseline mean | 7.6 | 7.5 |
| Adjusted mean change from baseline | -0.5 | -0.3 |
| Treatment difference: Apidra - Regelmæssig humant insulin 95% CI for treatment difference | -0,2 (-0,3; -0,1) | |
| Basal insulindosis (enheder/dag) | ||
| Baseline mean | 59 | 57 |
| Adjusted mean change from baseline | 6 | 6 |
| Kortvirkende insulindosis (enheder/dag) | ||
| Baseline mean | 32 | 31 |
| Adjusted mean change from baseline | 4 | 5 |
| Gennemsnitligt antal kortvirkende insulininjektioner pr. Dag | 2 | 2 |
| Kropsvægt (kg) | ||
| Baseline mean | 100.5 | 99.2 |
| Mean change from baseline | 1.8 | 2.0 |
| *GHB rapporteret som HBA1C -ækvivalent |
Type 1 diabetes-voksne: Pre-And Post-Meal Administration
En 12-ugers randomiseret open-label aktivkontrolleret ikke-mindrevinitetsundersøgelse blev udført hos patienter med type 1-diabetes for at vurdere sikkerheden og effektiviteten af Apidra administreret på forskellige tidspunkter med hensyn til et måltid. Apidra blev administreret subkutant enten inden for 15 minutter før et måltid (n = 286) eller umiddelbart efter et måltid (n = 296), og almindeligt humant insulin (n = 278) blev administreret subkutant 30 til 45 minutter før et måltid. Insulin -glargin blev administreret en gang dagligt ved sengetid som basalinsulin. Der var en 4-ugers run-in-periode med regelmæssig human insulin og insulin glargine efterfulgt af randomisering. De fleste patienter var kaukasiske (94%). Middelalderen var 40 år (område 18 til 73 år). Glykæmisk kontrol (se tabel 8) var sammenlignelig for de 3 behandlingsregimer. Ingen ændringer fra baseline mellem behandlingerne blev set i det samlede daglige antal kortvirkende insulininjektioner. (Se tabel 8.)
Tabel 8: Indgivelse af før-måltid i type 1-diabetes mellitus-voksne
| Behandling af behandlingsvarighed i kombination med: | 12 uger insulin glargine apidra før måltid | 12 ugers Sinsulin Glargine Apidra Post Meal | 12 ugerMinsulin glargine regelmæssig human insulin |
| Glycated hæmoglobin (GHB)* (%) | |||
| Antal patienter | 268 | 276 | 257 |
| Baseline mean | 7.7 | 7.7 | 7.6 |
| Adjusted mean change from baseline** | -0.3 | -0.1 | -0.1 |
| Basal insulindosis (enheder/dag) | |||
| Baseline mean | 29 | 29 | 28 |
| Adjusted mean change from baseline | 1 | 0 | 1 |
| Kortvirkende insulindosis (enheder/dag) | |||
| Baseline mean | 29 | 29 | 27 |
| Adjusted mean change from baseline | -1 | -1 | 2 |
| Gennemsnitligt antal kortvirkende insulininjektioner pr. Dag | 3 | 3 | 3 |
| Kropsvægt (kg) | |||
| Baseline mean | 79.2 | 80.3 | 78.9 |
| Mean change from baseline | 0.3 | -0.3 | 0.3 |
| *GHB rapporteret som HBA1C -ækvivalent ** Justeret gennemsnitlig ændring fra baseline -behandlingsforskellen (98,33% CI til behandlingsforskel): Apidra pre meal vs. Regelmæssig humant insulin -0.1 (-0.3; 0.0) Apidra post meal vs. Regelmæssig humant insulin 0.0 (-0.1; 0.2) Apidra post meal vs. pre meal 0.2 (0.0; 0.3) |
Type 1 diabetes-pediatriske patienter
En 26-ugers randomiseret open-label aktiv-kontrolleret ikke-mindrevinærundersøgelse blev udført hos børn og unge over 4 år med type 1-diabetes mellitus for at vurdere sikkerheden og effektiviteten af Apidra (n = 277) sammenlignet med insulin Lispro (n = 295), når de administreres subcutant inden for 15 minutter før et måltid. Patienter modtog også insulin glargine (administreret en gang dagligt om aftenen) eller NPH insulin (administreret en gang om morgenen og en gang om aftenen). Der var en 4-ugers run-in-periode med insulin lispro og insulin glargine eller NPH før randomisering. De fleste patienter var kaukasiske (91%). Halvtreds procent af patienterne var mandlige. Middelalderen var 12,5 år (område 4 til 17 år). Gennemsnitlig BMI var 20,6 kg/m². Glykæmisk kontrol (se tabel 9) var sammenlignelig for de to behandlingsregimer.
Tabel 9: Resultater fra en 26-ugers undersøgelse hos pædiatriske patienter med type 1-diabetes mellitus
| Apidra | Lispro | |
| Antal patienter | 271 | 291 |
| Basal insulin | NPH eller insulin glargine | NPH eller insulin glargine |
| Glycated hæmoglobin (GHB)* (%) | ||
| Baseline mean | 8.2 | 8.2 |
| Adjusted mean change from baseline | 0.1 | 0.2 |
| Treatment Difference: Mean (95% confidence interval) | -0,1 (-0,2 0,1) | |
| Basal insulindosis (enheder/kg/dag) | ||
| Baseline mean | 0.5 | 0.5 |
| Mean change from baseline | 0.0 | 0.0 |
| Kortvirkende insulindosis (enheder/kg/dag) | ||
| Baseline mean | 0.5 | 0.5 |
| Mean change from baseline | 0.0 | 0.0 |
| Gennemsnitligt antal kortvirkende insulininjektioner pr. Dag | 3 | 3 |
| Baseline gennemsnitlig kropsvægt (kg) | 51.5 | 50.8 |
| Gennemsnitlig vægtændring fra baseline (kg) | 2.2 | 2.2 |
| *GHB rapporteret som HBA1C -ækvivalent |
Type 1 diabetes-voksne: Continuous Subcutaneous Insulin Infusion
En 12-ugers randomiseret aktiv kontrolundersøgelse (Apidra versus insulin aspart) udført hos voksne med type 1-diabetes (Apidra N = 29 insulin aspart N = 30) vurderede brugen af Apidra i en ekstern kontinuerlig subkutan insulinpumpe. Alle patienter var kaukasiske. Middelalderen var 46 år (område 21 til 73 år). Den gennemsnitlige GHB steg fra baseline til slutpunkt i begge behandlingsgrupper (fra 6,8% til 7,0% for Apidra; fra 7,1% til 7,2% for insulin aspart).
Patientinformation til Apidra
Apidra
(uh pee slags)
(insulin glulisin [rekombinant DNA -oprindelse] injektion) opløsning til injektion
Læs de patientoplysninger, der følger med Apidra, før du begynder at tage dem, og hver gang du får en påfyldning. Der kan være nye oplysninger. Denne indlægsseddel indtager ikke stedet for at tale med din sundhedsudbyder om din diabetes eller behandling. Hvis du har spørgsmål om Apidra eller om diabetes, skal du tale med din sundhedsudbyder.
Hvad er Apidra?
Apidra is a man-made insulin used to control high blood sugar in adults og children with diabetes mellitus .
Det vides ikke, om Apidra er sikker eller effektiv i:
- Børn under 4 år med type 1 -diabetes
- Børn med type 2 -diabetes
Hvem skal ikke tage Apidra?
Tag ikke Apidra:
- Når dit blodsukker er for lavt (Hypoglykæmi). Se afsnittet Hvad er de mulige bivirkninger af Apidra?
- Hvis du er allergisk til nogen af ingredienserne i Apidra. Se slutningen af denne indlægsseddel for en komplet liste over ingredienser. Spørg din sundhedsudbyder, om du ikke er sikker.
Hvad skal jeg fortælle min sundhedsudbyder, før jeg tager Apidra?
Medicinske tilstande kan påvirke dine insulinbehov. Fortæl din sundhedsudbyder om alle dine medicinske tilstande, herunder hvis du:
- har lever- eller nyreproblemer.
- er gravid plan for at blive gravid eller ammer. Det vides ikke, om Apidra vil skade din ufødte baby eller sygeplejebarn. Du og din sundhedsudbyder skal tale om den bedste måde at håndtere din diabetes, mens du er gravid eller ammer. Det er især vigtigt at holde god kontrol over dit blodsukker under graviditeten.
- har hjertesvigt eller andre hjerteproblemer. Hvis du har hjertesvigt, kan det blive værre, mens du tager TZD'er med Apidra
Fortæl din sundhedsudbyder om alle de medicin, du tager inklusive receptpligtige og ikke-receptpligtige medicin vitaminer og urtetilskud, især dem, der ofte kaldes TZD'er (thiazolidinediones).
Kend de medicin, du tager. Opbevar en liste over dine medicin med dig og vis den til din sundhedsudbyder og farmaceut, når du får en ny medicin.
Hvordan skal jeg tage Apidra?
- Tag Apidra nøjagtigt som foreskrevet.
- Foretag ikke ændringer i din dosis eller type insulin, medmindre du får besked om at gøre det af din sundhedsudbyder.
- Kend dit insulin. Sørg for, at du ved:
- Typen og styrken af insulin, der er ordineret til dig
- mængden af insulin, du tager
- Det bedste tidspunkt for dig at tage dit insulin. Dette kan ændre sig, hvis du tager en anden type insulin, eller hvis du giver dine insulinændringer for eksempel ved hjælp af en insulinpumpe i stedet for at give injektioner under huden (subkutane injektioner).
- Apidra starts working faster than regular insulin but does not work as long.
- Apidra is usually used with a longer-acting insulin when given by injection under the skin (subcutaneous) or by itself when using an insulin pump.
- Læs instruktionerne til brug, der følger med din Apidra. Tal med din sundhedsudbyder, hvis du har spørgsmål. Din sundhedsudbyder skal vise dig, hvordan du injicerer Apidra, før du begynder at tage det.
- Din sundhedsudbyder vil ordinere den bedste type Apidra til dig. Apidra fås i:
- 3 ml Solostar® -præfyldt pen
- 10 ml hætteglas
- Du har brug for en recept for at få Apidra. Sørg altid for, at du modtager det rigtige insulin fra apoteket.
- Kontroller dit blodsukkerniveau inden hver brug af Apidra. Spørg din sundhedsudbyder, hvad dine blodsukker skal være, og hvornår du skal kontrollere dit blodsukkerniveau.
- Kontroller etiketten for at sikre dig, at du har den korrekte insulintype. Dette er især vigtigt, hvis du også tager langtidsvirkende insulin.
- Apidra should look clear og colorless. Do not use Apidra if it looks cloudy colored or has particles in it. Talk with your pharmacist or healthcare provider if you have any questions.
- Hvis du tager for meget Apidra, kan dit blodsukker falde lavt (hypoglykæmi). Du kan behandle mildt lavt blodsukker (hypoglykæmi) ved at drikke eller spise noget sukkerholdigt med det samme.
- Del ikke nåle insulinpenner eller sprøjter med andre.
Din dosis Apidra skal muligvis ændres på grund af:
- sygdom
- Ændring i diæt
- stress
- Ændring i fysisk aktivitet eller træning
- Andre medicin, du tager
- rejse
Tjek dit blodsukker og bliv på kosten og træningsplanen som foreskrevet af din sundhedsudbyder.
Hvad skal jeg overveje, mens jeg tager Apidra?
- Alkohol kan påvirke dit blodsukker, når du tager Apidra
- Kørsel og betjeningsmaskiner. Du har muligvis problemer med at være opmærksom eller reagere, hvis du har lavt blodsukker (hypoglykæmi). Vær forsigtig, når du kører en bil eller betjener maskiner. Spørg din sundhedsudbyder, om det er okay for dig at køre, hvis du har det:
- Lavt blodsukker (hypoglykæmi)
- nedsat eller ingen advarselsskilte om lavt blodsukker
Hvad er de mulige bivirkninger af Apidra?
Apidra can cause serious side effects including:
- Lavt blodsukker (hypoglykæmi). Symptomer på lavt blodsukker kan omfatte:
- Følelse af ængstelige eller irritable humørændringer
- Problemer med at koncentrere sig eller føle sig forvirret
- prikken i dine hænder fødder læber eller tunge
- Følelse af svimmel lys eller døsig
- Mareridt eller problemer med at sove
- hovedpine
- sløret vision
- sløret tale
- Et hurtigt hjerteslag
- sved
- Shakakess
- Gå ustabil
Meget lavt blodsukker (hypoglykæmi) kan forårsage bevidstløshed (bortført) anfald og død. Tal med din sundhedsudbyder om, hvordan du fortæller, om du har lavt blodsukker, og hvad du skal gøre, hvis dette sker, mens du tager Apidra. Kend dine symptomer på lavt blodsukker. Følg din sundhedsudbyders instruktioner til behandling af dit lave blodsukker.
Tal med din sundhedsudbyder, hvis lavt blodsukker er et problem for dig. Din dosis Apidra skal muligvis ændres.
- Alvorlige allergiske reaktioner.
Få medicinsk hjælp med det samme, hvis du har nogen af disse symptomer på en alvorlig allergisk reaktion:
- et udslæt over hele din krop
- åndenød
- Problemer med vejrtrækning (hvæsende)
- Hurtig puls
- sved
- Føl dig svag (på grund af lavt blodtryk)
- Lavt kalium i dit blod. Din læge vil tjekke dig for dette.
Almindelige bivirkninger inkluderer:
- Reaktioner på injektionsstedet (lokal allergisk reaktion). Du kan få rødme og kløe på injektionsstedet. Hvis du fortsat har hudreaktioner, eller de er seriøse snak med din sundhedsudbyder.
- Hudfortykning eller grober på injektionsstedet. Injicer ikke insulin i huden, hvor dette er sket. Vælg et injektionsområde (overarmen lår eller maveområde). Skift injektionssteder i det område, du vælger med hver dosis. Injicer ikke på det nøjagtige samme sted for hver injektion.
- Vægtøgning
Hjertesvigt . At tage visse diabetespiller kaldet thiazolidinedions eller TZD'er med Apidra kan forårsage hjertesvigt hos nogle mennesker. Dette kan ske, selvom du aldrig har haft hjertesvigt eller hjerteproblemer før. Hvis du allerede har hjertesvigt, kan det blive værre, mens du tager TZD'er med Apidra. Din sundhedsudbyder skal overvåge dig nøje, mens du tager TZD'er med Apidra. Fortæl din sundhedsudbyder, hvis du har nye eller værre symptomer på hjertesvigt, herunder:
- åndenød
- Hævelse af dine ankler eller fødder
- Pludselig vægtøgning
Under behandling med TZDS og Apidra kan TZD -dosis muligvis justeres eller stoppes af din sundhedsudbyder, hvis du har ny eller værre hjertesvigt.
Fortæl din sundhedsudbyder om enhver bivirkning, der generer dig, eller som ikke forsvinder. Dette er ikke alle de mulige bivirkninger af Apidra.
Ring til din læge for medicinsk rådgivning om bivirkninger. Du kan rapportere bivirkninger til FDA på 1800-332-1088.
Hvordan skal jeg opbevare Apidra?
- Se patientinstruktionerne til brug, der følger med din Apidra til specifikke lagringsinstruktioner.
Uåbnet Apidra:
- Brug ikke Apidra efter udløbsdatoen stemplet på etiketten.
- Opbevar alle uåbnede Apidra i køleskabet mellem 36 ° F til 46 ° F (2 ° C til 8 ° C).
- Frys ikke. Brug ikke Apidra, hvis det er frosset.
- Hold Apidra væk fra direkte varme og lys.
- Uåbnede hætteglas og Solostar, der ikke blev opbevaret i et køleskab, skal bruges inden for 28 dage efter åbningen.
Generel information om Apidra
Medicin er undertiden ordineret til tilstande, der ikke er nævnt i patientinformationsoplysninger. Brug ikke Apidra til en betingelse, som den ikke blev ordineret til. Giv ikke Apidra til andre mennesker, selvom de har de samme symptomer, du har. Det kan skade dem.
Denne indlægsseddel opsummerer den vigtigste information om Apidra. Hvis du gerne vil have flere oplysninger, skal du tale med din sundhedsudbyder. Du kan bede din sundhedsudbyder om information om Apidra, der er skrevet til udbydere af sundhedsydelser. For mere information om Apidra, ring 1-800-633-1610 eller gå til www.apidra.com.
Hvad er ingredienserne i Apidra?
Aktiv ingrediens: insulin glulisin
Inaktive ingredienser: Metacresol tromethamin natriumchlorid polysorbat 20 vand til injektion saltsyre eller natriumhydroxid
Yderligere oplysninger
Diabetesprognose er et nationalt magasin designet specielt til patienter med diabetes og deres familier og er tilgængeligt ved abonnement fra American Diabetes Association (ADA) P.O. Boks 363 Mt. Morris IL 61054-0363 1-800-Diabetes (1-800-342-2383). Du kan også besøge ADA -webstedet på www.diabetes.org.
En anden publikation Nedtælling er tilgængelig fra Juvenile Diabetes Research Foundation International (JDRF) 120 Wall Street 19. sal New York New York 10005 1800-JDF-Cure (1-800-533-2873). Du kan også besøge JDRF -webstedet på www.jdf.org. For at få mere information om diabetes skal du tjekke med din sundhedsudbyder eller diabetespædagog eller besøge www.diabeteswatch.com.
For mere information om Apidra, ring 1-800-633-1610 eller besøg www.apidra.com.
Apidra® SoloStar®
(Insulin Glulisin [RDNA Oprindelsesinjektion) 3 ml Foretfyldt pen
Patientinstruktioner til brug
Sørg for, at du læser forstå og følger disse instruktioner, før du bruger din Apidra Solostar®. Tal med din sundhedsudbyder om den rigtige måde at bruge din Apidra Solostar, før du bruger den for første gang. Opbevar denne indlægsseddel, hvis du skal se på den igen senere.
Apidra SoloStar should not be used by people who are blind or have severe vision problems without the help of a person who has good eyesight og who is trained to use the Apidra SoloStar the right way.
Apidra SoloStar is a disposable prefilled pen used to inject Apidra. Each Apidra SoloStar has 300 units of insulin which can be used for many doses. You can select a dose from 1 to 80 units. The pen plunger moves with each dose. The plunger will only move to the end of the cartridge when 300 units of insulin have been given.
 |
Hvis du giver dig selv subkutane injektioner af Apidra:
- Du skal tage Apidra inden for 15 minutter før et måltid eller inden for 20 minutter efter start af et måltid.
- Injicer ikke Apidra, hvis du ikke skal spise inden for 15 minutter.
- Injicerer Apidra i huden på din overarms lår eller maveområde. Injicerer ikke Apidra i en vene eller i en muskel.
- Vælg et injektionsområde (overarmen lår eller maveområde). Skift injektionssteder i det område, du vælger med hver dosis. Injicer ikke på det nøjagtige samme sted for hver injektion.
Vigtig information til brug af Apidra Solostar:
- Brug en ny nål til hver injektion. Apidra Solostar kan bruges sammen med pen nåle fra Becton Dickinson og firmaet Ypsomed og Owen Mumford. Kontakt din sundhedsudbyder for yderligere information.
- Lav en sikkerhedstest inden hver injektion. (Se trin 3.)
- Vælg ikke en dosis eller tryk på injektionsknappen uden en nål, der er fastgjort.
- Del ikke din Apidra Solostar med andre, selvom de har diabetes.
- Hvis din injektion gives af en anden person, skal denne person være omhyggelig med at undgå utilsigtet nålestokkeskade og forhindre, at der er passeret (transmission af) infektion.
- Brug ikke Apidra Solostar, hvis det er beskadiget, eller hvis du ikke er sikker på, at det fungerer korrekt.
- Bær altid en ekstra Apidra Solostar -præfyldt pen, hvis din Apidra Solostar er tabt eller beskadiget.
Trin 1. Forberedelse til en injektion
Sørg for, at du har følgende emner:
- Apidra Solostar
- Pen nåle
- Alkoholpinde
- Punkteringsbestandig beholder. Se hvordan bortskaffer jeg brugte nåle og Apidra Solostar?.
- Kontroller etiketten på din Apidra Solostar for at sikre dig, at du har det rigtige insulin. Apidra Solostar er blå. Den har en mørkeblå injektionsknap med en hævet ring på toppen.
- Kontroller udløbsdatoen placeret på kartonen eller etiketten på din Apidra Solostar for at sikre dig, at datoen ikke er gået. Brug ikke en Apidra Solostar, hvis datoen er gået.
- Fjern pennehætten.
- Se på insulinet i din Apidra Solostar. Kontroller, at insulinet ser klart ud. Brug ikke denne Apidra Solostar, hvis insulinet er overskyet farvet eller har partikler i det.
Trin 2. Vedhæftning af nålen
Brug altid en ny steril nål til hver injektion til at forhindre forurening og potentielle nålblokke.
Læs Pen Needle -instruktionerne til brug, før du bruger dem.
Bemærk: Pen nåle kan se anderledes ud. De viste penne nåle er kun til illustrative formål.
- Tør gummisætningen med alkohol.
- Fjern den beskyttende tætning fra den nye pennål.
- Line nålen op med pennen, og hold den lige, når du fastgør den (skru eller tryk på afhængigt af nåletypen).
 |
- Hvis du ikke holder nålen lige, mens du fastgør den, kan dette beskadige gummisætningen og forårsage lækage af insulin eller bryde nålen.
 |
Trin 3. Gør en sikkerhedstest
Lav en sikkerhedstest inden hver injektion for at sikre dig, at du får den rigtige dosis af Apidra. Sikkerhedstesten:
- sørger for, at pennen og nålen fungerer korrekt
- Fjerner luftbobler
A. Vælg en dosis på 2 enheder ved at dreje doseringsvælgeren.
 |
B. Fjern den ydre nålhætte og hold den for at fjerne den brugte nål efter injektion. Fjern den indre nålhætte og bortskaff den.
 |
C. Hold pennen med nålen, der peger opad.
D. Tap på insulinreservoiret, så enhver luftbobler stiger op mod nålen.
E. Tryk på injektionsknappen helt ind. Kontroller, om insulin kommer ud af nålspidsen.
 |
Du skal muligvis udføre sikkerhedstesten mere end én gang, før du ser insulinet.
- Hvis der ikke kommer nogen insulin, skal du tjekke for luftbobler og gentage sikkerhedstesten to gange mere for at fjerne dem.
- Hvis der stadig ikke kommer nogen insulin ud, kan nålen blokeres. Skift nålen, og prøv igen.
- Hvis der ikke kommer nogen insulin efter at have ændret nålen, kan din Apidra Solostar blive beskadiget. Brug ikke denne Apidra Solostar.
Trin 4. Valg af din dosis
Vælg den Apidra -dosis, der er foreskrevet af din sundhedsudbyder. Du kan vælge insulindosis i trin på 1 enhed fra mindst 1 enhed til højst 80 enheder. Hvis du har brug for en dosis større end 80 enheder, skal du give den som to eller flere injektioner.
A. Kontroller, at dosisvinduet viser 0 efter sikkerhedstesten.
B. Vælg din nødvendige dosis (i eksemplet nedenfor er den valgte dosis 30 enheder). Hvis du vender forbi din dosis, kan du vende tilbage.
 |
- Tryk ikke på injektionsknappen, mens insulinet drejer.
- Du kan ikke dreje doseringsvælgeren vedtaget antallet af enheder, der er tilbage i pennen. Tving ikke doseringsvælgeren til at dreje. I dette tilfælde kan du enten injicere mængden af insulin, der stadig er i pennen og afslutte din dosis med en ny Apidra Solostar, eller du kan bruge en ny Apidra Solostar til din fulde dosis.
Trin 5. Giv injektionen
A. Giv injektionen nøjagtigt som vist for dig af din sundhedsudbyder.
B. Indsæt nålen i din hud.
 |
C. Injicerer dosis ved at trykke på injektionsknappen i hele vejen. Tryk kun på injektionsknappen, når du er klar til at injicere. Nummeret i dosisvinduet vender tilbage til 0, når du injicerer.
 |
D. Hold injektionsknappen trykket helt ind. Tæl langsomt til 10, før du tager nålen ud af din hud. Dette vil sikre, at den fulde dosis er blevet givet.
Trin 6. Fjernelse og bortskaffelse af Pen Needle
Fjern altid Pen Needle efter hver injektion, og opbevar din Apidra Solostar uden en nål fastgjort. Dette hjælper med at forhindre:
- Forurening og infektion
- Luft fra at komme ind i insulinreservoiret og lækage af insulin. Dette vil hjælpe med at sikre dig, at du injicerer den rigtige dosis af insulin.
A. Følg instruktionerne fra din sundhedsudbyder, når du fjerner og bortskaffer nålen. Spring for eksempel den ydre nålhætte tilbage på nålen og brug den til at skrue den brugte nål fra pennen. For at mindske risikoen for utilsigtet nålestokkeskade og passering af infektion:
- Hold ikke sammen med nåle med fingrene
- Udskift aldrig den indre nålhætte.
Hvis din injektion gives af en anden person, skal denne person også være forsigtig, når man fjerner og bortskaffer nåle for at forhindre utilsigtet nålestokkeskade og passere infektion.
B. Bortskaf nålen på den rigtige vej ind i din specielle punkteringsbestandige beholder (se hvordan bortskaffer jeg brugte nåle og Apidra Solostar?).
C. Sæt altid penhætten tilbage på pennen, opbevar derefter Apidra Solostar, indtil din næste injektion.
Hvordan bortskaffer jeg brugte nåle og Apidra Solostar?
- Kontakt din sundhedsudbyder for instruktioner om den rigtige måde at bortskaffe brugte nåle og Apidra Solostar. Der kan være lokale eller statslige love om, hvordan man smider brugte nåle og Apidra Solostar. Bortskaf ikke brugte nåle eller Apidra Solostar i husholdningspas og genanvender dem ikke.
- Sæt brugte nåle og brugte tomme Apidra Solostar i en beholder lavet specielt til bortskaffelse af brugte sprøjter og nåle (kaldet en skarp beholder) eller en hård plastbeholder (såsom tomme vaskemiddelflasker) med en skrueknap eller metalbeholder med en plastik låg mærket brugte sprøjter. Disse containere skal forsegles og bortskaffes på den rigtige måde.
Hvordan skal jeg opbevare Apidra Solostar?
- Køl ikke Apidra Solostar efter første brug.
- Opbevares ved stuetemperatur under 25 ° C (25 ° C).
- Bortskaf enhver åbnet Apidra Solostar 28 dage efter første brug.
Opretholdelse
- Beskyt din Apidra Solostar mod støv og snavs.
- Du kan rense ydersiden af din Apidra Solostar ved at tørre den med en fugtig klud.
- Blød ikke vask eller smør pennen, da dette kan skade den.
- Håndter din Apidra Solostar med omhu. Undgå situationer, hvor din Apidra Solostar kan blive beskadiget. Hvis du er bekymret for, at din Apidra Solostar kan blive beskadiget, skal du bruge en ny.
Hvis du har spørgsmål om Apidra Solostar eller om diabetes, skal du spørge din sundhedsudbyder gå til www.apidra.com eller ringe til Sanofi-Agentis U.S. på 1-800-633-1610.