Cefotan
Oplysningerne På Webstedet Er Ikke Medicinsk Rådgivning. Vi Sælger Ikke Noget. Nøjagtigheden Af Oversættelsen Er Ikke Garanteret. Ansvarsfraskrivelse
Resume af lægemiddeloversigt
Hvad er Cefotan?
Cefotan (cefotetan -disodium til injektion) er et antibiotikum, der kun bruges til at behandle eller forhindre infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af modtagelige bakterier. Mærkenavnet Cefotan er afbrudt, men generiske versioner kan være tilgængelige.
Hvad er bivirkninger af Cefotan?
Cefotan
- elveblest
- Besvær
- Hævelse af dine ansigtslæber tunge eller hals
- Alvorlig mavesmerter
- diarré, der er vandig eller blodig
- Bleg eller gulnet hud
- Mørk farvet urin
- feber
- forvirring
- svaghed
- anfald
- lidt eller ingen vandladning
- Smertefuld eller vanskelig vandladning
- hævelse i dine fødder eller ankler
- træthed
- åndenød
- Pludselig svaghed
- syg følelse
- kulderystelser
- ondt i halsen
- Mundsår
- Rød eller hævet tandkød
- problemer med at sluge
- Let blå mærker
- Usædvanlig blødning (næsemundvagina eller endetarm)
- lilla eller røde præciser på din hud
- ondt i halsen
- brændende i dine øjne og
- Hudsmerter efterfulgt af et rødt eller lilla hududslæt, der spreder sig (især i ansigtet eller overkroppen) og forårsager blærende og skrælning
Få medicinsk hjælp med det samme, hvis du har nogen af de symptomer, der er anført ovenfor.
Almindelige bivirkninger af cefotan (cefotetan -disodium til injektion) inkluderer:
Hvad bruges dicyclomine HCL til
- reaktioner på injektionsstedet (hævelse af rødme med rødme eller ømhed)
- Tab af appetit
- kvalme
- opkast
- mavesmerter
- diarre
- hovedpine eller
- Vaginal kløe eller udflod.
Fortæl din læge, hvis du har sjældne, men meget alvorlige bivirkninger af Cefotan (Cefotetan Disodium til injektion), herunder:
- Mørk urin
- Let blå mærker or bleeding
- Hurtig/bankende/uregelmæssig hjerteslag
- anfalds
- usædvanlig svaghed
- gulende øjne eller hud eller
- Mental/humørændringer (såsom forvirring).
Søg medicinsk behandling eller ring 911 på én gang, hvis du har følgende alvorlige bivirkninger:
- Alvorlige øjensymptomer såsom pludseligt synstab sløret synet tunnel vision øje smerter eller hævelse eller at se haloer omkring lys;
- Alvorlige hjertesymptomer såsom hurtig uregelmæssige eller bankende hjerteslag; flagrende i brystet; åndenød; og pludselig svimmelhed letthed eller udlevering;
- Alvorlig hovedpine forvirring sløret talearm eller ben svaghed problemer med at gå tab af koordination føles ustabil meget stive muskler høj feber voldsom sved eller rysten.
Dette dokument indeholder ikke alle mulige bivirkninger, og andre kan forekomme. Kontakt din læge for yderligere oplysninger om bivirkninger.
Dosage for Cefotan
Den sædvanlige voksne dosering er 1 eller 2 gram Cefotan administreret intravenøst eller intramuskulært hver 12. time i 5 til 10 dage.
Hvilke stoffer stoffer eller kosttilskud interagerer med Cefotan?
Cefotan kan interagere med aminoglycosider. Fortæl din læge alle medicin og kosttilskud, du bruger.
Cefotan under graviditet eller amning
Fortæl din læge, hvis du er gravid eller planlægger at blive gravid, før du bruger Cefotan. Dette lægemiddel passerer til modermælk i meget lave koncentrationer. Konsulter din læge, før du breaset.
Yderligere oplysninger
Vores Cefotan (Cefotetan Disodium til injektion) Bivirkninger Drug Center giver et omfattende overblik over tilgængelige lægemiddelinformation om de potentielle bivirkninger, når du tager denne medicin.
FDA -lægemiddelinformation
- Lægemiddelbeskrivelse
- Indikationer
- Dosering
- Bivirkninger
- Advarsler
- Forholdsregler
- Overdosis
- Klinisk farmakologi
- Medicin vejledning
Beskrivelse for Cefotan
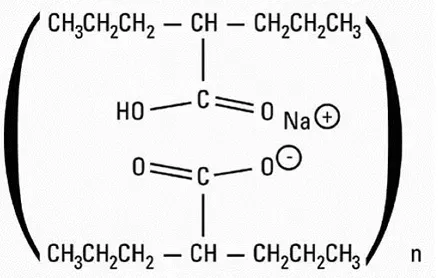
Cefotan ™ (cefotetan til injektion USP) som cefotetan diso dium er en steril SE misyntetisk bredspektret beta-lac tamase resistent cephalosporin (cephamyc in) antibakteriel for parenteral administration. Det er disodiumsalt af [6 R -(6a7a) -7-[[[ H -te trazo l-5-yl) thio] me thyl] -8-oxo5-thia-1-azabicyclo [4 .2.0] o ct-2-en-2-carbo xylsyre. Strukturel fo rmula:
 |
Cefotan ™ (cefotetan til injektion USP) leveres i hætteglas indeholdende 80 mg (3,5 meq) natrium pr. Gram cefotetan -aktivitet. Det er et hvidt at lysegult pulver, der er meget opløseligt i vand. Rekonstituerede opløsninger af Cefotan ™ (Cefotetan til injektion USP) er beregnet til intravenøs og intramusc ular administration. Opløsningen varierer fra farveløs til gul afhængigt af koncentrationen. PH af friskrekonstituerede opløsninger er normalt mellem 4,5 til 6,5.
Cefotan ™ (Cefotetan til injektion USP) fås i to hætteglasstyrker. Hver 1 gram hætteglas indeholder cefotetan -disodium svarende til 1 gram cefotetan -aktivitet. Hver 2 gram hætteglas indeholder cefotetan -disodium svarende til 2 g Rams cefotetan -aktivitet.
Bruger til Cefotan
For at reducere udviklingen af lægemiddelresistente bakterier og opretholde effektiviteten af Cefotan ™ og andre antibakterielle lægemidler skal Cefotan ™ kun bruges til at behandle eller forhindre infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af modtagelige bakterier. Når information om kultur og følsomhed er tilgængelige, skal de overvejes ved valg eller ændring af antibakteriel terapi. I mangel af sådanne data kan lokal epidemiologi og følsomhedsmønstre bidrage til det empiriske udvalg af terapi.
Behandling
Cefotan ™ (cefotetan til injektion USP) er indikeret til den terapeutiske behandling af følgende infektioner, når de er forårsaget af modtagelige stammer af de udpegede o rg -anismer:
Urinvejsinfektioner forårsaget af E. coli Klebsiella SPP (inklusive K. pneumoniae ) Proteus Vidunderlig Proteus vulgær levering rettgeri og Morganella Morganies .
Infektioner i lavere luftvej forårsaget af Streptococcus pneumoniae Staphylococcus aureus (methicillin modtagelig) Haemophilus influenzae Klebsiella arter (inklusive K. pneumoniae ) E. coli Proteus vidunderligt og Serratia marcescens. *
Infektioner i hud og hudstruktur på grund af Staphylococcus aureus (Methicillinsusceptible) Staphylococcus epidermidis (methicillin modtagelig) Streptococcus pyogenes Streptococcus arter Escherichia coli klebsiella pneumoniae peptococcus niger* peptostreptococcus arter.
Gynækologiske infektioner forårsaget af Staphylococcus aureus (methicillin modtagelig) Staphylococcus epidermidis (Methicillin modtagelig Streptococcus arter Streptococcus agalactiae E. coli Proteus vidunderligt Neisseria Gonorrhoeae Bacteroides Fragile Prevotella melaninogenica Bacteroides vulgatus Fusobacterium arter* og gram-positive anaerobic cocci (including Peptococcus Niger og Peptostreptococcus arter).
Cefotetan som andre cephalosporiner har ingen aktivitet imod Chlamydia trachomas . Derfor, når cephalosporiner anvendes til behandling af bækkeninflammatorisk sygdom og C. trachomatis er en af de mistænkte patogener, der er passende antiklamydial dækning, skal tilsættes.
Intra-abdominale lnfektioner forårsaget af E. coli Klebsiella arter (inklusive K. pneumoniae ) Streptococcus arter Bacteroides Fragile Prevotella melaninogenica Bacteroides vulgatus og Clostridium arter (other than Clostridium difficile (se Advarsler )*.
Knogler og ledinfektioner forårsaget af Staphylococcus aureus (methicillin modtagelig)*.
* Effektivitet for denne organisme i dette organsystem blev undersøgt i færre end ti infektioner i kliniske studier
Prøver til bakteriologisk undersøgelse bør opnås for at isolere og identificere årsagssammenhæng og for at bestemme deres følsomhed over for cefotetan. Terapi kan indføres, før resultaterne af følsomhedsundersøgelser er kendt; Men når disse resultater, som jeg er tilgængelig på, skal antibiotikabehandlingen justeres i overensstemmelse hermed.
I tilfælde af bekræftet eller mistænkt G RAM-positiv eller gram-negativ sepsis eller hos patienter med andre alvorlige infektioner, hvori den årsagssammenhængende anisme ikke er blevet identificeret, er det muligt at bruge Cefotan ™ co nco med et amino-glycosid. Cefotetan-kombinationer med aminoglycosider har vist sig at være syne rg istic in vitro mod mange Enterobacteriaceae og også så mig andre gramnegative bakterier. Doseringen, der blev modtaget i mærkning af både antibiotika, kan gives og afhænger af sværhedsgraden af informeringen og patientens tilstand.
NOTE: Stigninger i serumkreatinin er forekommet, da Cefotan ™ blev givet alene. Hvis Cefotan ™ og et aminoglycosid anvendes, skal den samlede nyrefunktion omhyggeligt være mo nito -rød, fordi nefrotoksicitet kan forstærkes.
Profylakse
Den præoperative administration af Cefotan ™ kan reducere forekomsten af visse postoperative infektioner hos patienter, der gennemgår kirurgiske procedurer, der er klassificeret som ren kontamineret eller potentielt forurenet (f.eks. Kesarisk sektion abdominal eller vaginal hysterektomi transurethral kirurgi biliær traktkirurgi og gastrointestinal kirurgi).
Hvis der er tegn og symptomer på infektionsprøver for kultur, skal der opnås til identifikation af den forårsagende organisme, så passende terapeutiske foranstaltninger kan initieres.
Dosage for Cefotan
Behandling
Den sædvanlige voksne dosering er 1 gram (g) eller 2 g rams af Cefotan ™ (cefotetan til injektion USP) administreret intravenøst eller intramusc ularly. Korrekt dosering og vej til administration bør være de te rmine d ved tilstanden af patientens sværhedsgrad af infektionen og modtageligheden af den årsagssammenhængende anisme.
Generelle retningslinjer for dosering af Cefotan ™ (Cefotetan til injektion USP)
| Infektionstype | Daglig dosis | Frekvens og rute |
| Urinvej | 1 g til 4 g | 500 mg hver 12. time intravenøs eller intramuskulær 1 eller 2 g hver 24 timer intravenøs eller intramuskulær 1 eller 2 g hver 12. time intravenøs eller intramuskulær |
| Hud | ||
| Mild - moderata | 2 g | 2 g every 24 hours intravenous 1 g hver 12. time intravenøs eller intramuskulær |
| Alvorlig | 4 g | 2 g every 12 timerours intravenous |
| Andre websteder | 2 g to 4 g | 1 g eller 2 g hver 12. time intravenøs eller intramuskulær |
| Alvorlig | 4 g | 2 g every 12 timerours intravenous |
| Livstruende | 6 gb | 3 g hver 12. time intravenøs |
| a Klebsiella pneumoniae Infektioner i hud- og hudstrukturer skal behandles med 1 eller 2 gram hver 12. time intravenøs eller intramuskulær. b Maksimal daglig dosering bør ikke overstige 6 gram. |
Hvis Chlamydia trachomas er en mistænkt patogen i gynækologiske infektioner, der er passende antiklamydial dækning, skal tilsættes, da cefotetan ikke har nogen aktivitet mod denne organisme.
Profylakse
For at forhindre postoperativ infektion i rent forurenet eller potentielt forurenet kirurgi hos voksne er den anbefalede dosis 1 eller 2 g Cefotan ™ (Cefotetan til injektion USP), der administreres en gang intravenøst 30 til 60 minutter før operationen. Hos patienter, der gennemgår kejsersnit, skal dosis administreres, så snart navlestrengen er fastklemt.
Nedsat nyrefunktion
Når nyrefunktion er nedsat, skal der anvendes en reduceret doseringsplan. Fo llowing doseringsretningslinjerne kan anvendes.
Doseringsretningslinjer for patienter med nedsat nyrefunktion
| Kreatinin Clearance | Dosis | Frekvens |
| Større end 30 | Almindelig anbefalet dosering* | Hver 12. time |
| 10 til 30 | Almindelig anbefalet dosering* | Hver 24 timer |
| Mindre end 10 | Almindelig anbefalet dosering* | Hver 48 time |
| * Dosis bestemt af typen og sværhedsgraden af infektion og følsomhed af den årsagsorganisme. |
Alternativt kan doseringsintervallet forblive konstant med 12 timers intervaller, men dosis reduceres til halvdelen af den sædvanlige anbefalede dosis til patienter med en kreatininklarering på 10 til 30 ml/min og en fjerdedel af den sædvanlige anbefalede dosis til patienter med en kreatininklarering på mindre end 10 ml/min.
Når kun serumkreatininniveauer er tilgængelige, kan kreatininklarering beregnes ud fra følgende formel. Serumkreatininniveauet skal repræsentere en stabil tilstand af nyrefunktion.
| Hanner: | (vægt i kg) x (140 - alder) |
| (72) x serumkreatinin (mg/100 ml) | |
| Kvinder: | (0,85) x (over værdi) |
Cefotetan er dialyzbart, og det er henvist til, at for patienter, der gennemgår intermitterende hemo-dialyse en fjerdedel af den sædvanlige rec o mmended dosis, gives hver 24 timer på dage mellem dialyse og halvdelen af den sædvanlige anbefalede dosis på dialysis dag.
Forberedelse af opløsning
Til intravenøs brug
Rekonstitueret med sterilt vand til injektion. Ryst for at opløses og lad stå, indtil det er klart.
| Hætteglasstørrelse | Mængde til tilføjet fortyndingsmiddel (ML) | Omtrentlig tilbagetrækkeligt volumen (ML) | Omtrentlig gennemsnitlig koncentration (mg /ml) |
| 1 gram | 10 | 10.5 | 95 |
| 2 gram | 10 til 20 | 11 til 21 | 182 til 95 |
Til intramuskulær brug
Rekonstitueret med sterilt vand til injektion; Bakteriostatisk vand til injektion; Natriumchloridinjektion 0,9% USP; 0,5% lidocaine HCl; eller 1% lidocaine HCL. Ryst for at opløses og lad stå, indtil det er klart.
| Hætteglasstørrelse | Mængde til tilføjet fortyndingsmiddel (ML) | Omtrentlig tilbagetrækkeligt volumen (ML) | Omtrentlig gennemsnitlig koncentration (mg /ml) |
| 1 gram | 2 | 2.5 | 400 |
| 2 gram | 3 | 4 | 500 |
Intravenøs administration
Den intravenøse rute foretrækkes for patienter med bakteræmi-bakteriel septikæmi eller andre alvorlige eller livstruende infektioner eller for patienter, der kan være dårlige risici på grund af nedsat modstand som følge af sådanne svækkende tilstande som underernæring traumekirurgi-diabetes hjertesvigt eller malignitet, især hvis chok er til stede eller imponerer.
Til intermitterende intravenøs administration kan en opløsning indeholde 1 gram eller 2 gram Cefotan ™ (cefotetan til injektion USP) i sterilt vand til injektion injiceres over en periode på tre til fem minutter. Ved hjælp af et infusionssystem kan løsningen også gives over en længere periode gennem det rørsystem, hvormed patienten muligvis modtager andre intravenøse opløsninger. Sommerfugl® Eller nåle af hovedbundsvenen foretrækkes til denne type infusion. Imidlertid under infusio n af opløsningen, der indeholder Cefotan ™ (Cefotetan til injektion USP), tilrådes det at afbryde tempoet administration af andre løsninger på det samme sted.
NOTE: Opløsninger af cefotetan må ikke blandes med opløsninger indeholdende amino -glycosider. Hvis Cefotan ™ og amino glycosider skal administreres til den samme patient, skal de administreres separat og ikke som en blandet injektion.
Intramuskulær administration
Som med alle intramuskulære præparater bør Cefotan ™ (cefotetan til injektion USP) injiceres godt inden for kroppen af en relativt stor muskel, såsom den øverste ydre kvadrant af balderen (dvs. gluteus maximus); Aspiration er nødvendig for at undgå utilsigtet injektion i et blodkar.
Kompatibilitet og stabilitet
Frosne prøver skal optøes ved stuetemperatur inden brug. Efter nedenstående perioder skal eventuelle ubrugte opløsninger eller frosset materiale kasseres. Afbryd ikke.
NOTE: Solutions of CEFOTAN™ (cefotetan for Injection USP) must not be admixed with solutions containing aminoglycosides. Hvis CEFOTAN™ (cefotetan for Injection USP) og aminog lycosides are to be administered to the same patient they must be administered separately og not as a mixed injection. Tilsæt ikke supplerende medicin.
Cefotan ™ (Cefotetan til injektion USP) rekonstitueret som beskrevet ovenfor (se Dosering og administration Forberedelse af opløsning ) opretholder tilfredsstillende styrke i 24 timer ved stuetemperatur (25 ° C/77 ° F) i 96 timer under køling (5 ° C/41 ° F) og i mindst 1 uge i den frosne tilstand (-20 ° C/4 ° F). Efter rekonstitution og efterfølgende opbevaring i engangsglas eller plastsprøjter er Cefotan ™ (Cefotetan til injektion USP) stabil i 24 timer ved stuetemperatur og 96 timer under køling.
NOTE: Parenteral drug products should be inspected visually for particulate matter og discoloration prior to administration whenever solution og container pe rmit.
Hvor leveret
Cefotan ™ (cefotetan til injektion USP) er en tør hvid til lysegult pulver leveret i hætteglas, der indeholder cefotetan -disodium svarende til 1 g og 2 g cefotetan -aktivitet til intravenøs og intramuskulær administration. Hætteglassene skal opbevares ved 20 ° C til 25 ° C (68 ° til 77 ° F) [se USP -kontrolleret stuetemperatur] og skal beskyttes mod lys.
De følgende pakker er tilgængelige:
| NDC No. | Styrke | |
| 52565-052-10 | 1 gram | 10 ml hætteglas pakket i en bakke på 10. |
| 52565-053-20 | 2 grams | 20 ml hætteglas pakket i en bakke på 10. |
Hætteglasstoppere indeholder ikke naturgummi latex.
Fremstillet til: Telent Pharma Inc. Buena NJ 08310 lavet i Italien. Revideret: marts 2017.
Bivirkninger for Cefotan
I kliniske studier blev følgende bivirkninger samlet relateret til cefotan -terapi. De, der vises i kursiv, er rapporteret under oplevelse af postmarketing.
Gastrointestinal
Symptomer forekom hos 1,5% af patienterne, som hyppige var diarré (1 ud af 80) og kvalme (1 ud af 700); Pseudomembranøs colitis . Begyndelse af pseudomembranøse colitis -symptomer kan forekomme under eller efter antibiotikabehandling eller kirurgisk profylakse (se Advarsler ).
ketoconazolcreme til gærinfektionsdosering
Hæmatologisk
Laboratorie abnormaliteter forekom hos 1,4% af patienterne og inkluderede eosinophilia (1 ud af 200) positive direkte Coombs -test (1 ud af 250) og thrombocytose (1 ud af 300); Agranulocytose Hemolytisk anæmi leukopeni trombocytopeni og langvarig protrombintid med eller uden blødning.
Lever
Enzymhøjder forekom hos 1,2% af patienterne og inkluderede en stigning i ALT (SGPT) (1 i 150) AST (SGOT) (1 ud af 300) Alkalisk phosphatase (1 ud af 700) og LDH (1 ud af 700).
Overfølsomhed
Reaktioner blev rapporteret hos 1,2% af patienterne og inkluderede udslæt (1 ud af 150) og kløe (1 ud af 700); Anafylaktiske reaktioner og urticaria.
Lokal
Effekter blev rapporteret hos mindre end 1% af patienterne og inkluderede phlebitis på injektionsstedet (1 ud af 300) og ubehag (1 ud af 500).
Nyre
Forhøjelser i bolle og serumkreatinin er rapporteret.
Urogenital
Nefrotoksicitet er sjældent rapporteret.
Diverse
Feber
In addition to the adverse reactions listed above which have been observed in patients treated with cefotetan the fo llo wing adverse reactions and altered laboratory tests have been reported for cephalo spo rin-class antibiotics: pruritus Stevens-Johnson syndrome erythema multifo rme toxic epidermal necrolysis vomiting abdominal pain colitis superinfection vaginitis including vaginal candidiasis renal dysfunction toxic nephropathy hepatic dysfunction including cholestasis aplastic anemia he mo rrhage elevated bilirubin pancytopenia and neutropenia .
Flere cephalosporiner er blevet impliceret til at udløse anfald, især hos patienter med nedsat nyrefunktion, når doseringen ikke blev reduceret (se Dosering og administration og OVERDOSIS ). Hvis anfalds associated with drug therapy occur the drug should be discontinued. Anticonvulsant therapy can be given if clinically indicated.
At rapportere Mistænkte bivirkninger Kontakt Telent Pharma Inc. på 1-856-697-1441 eller FDA på 1-800-FDA-1088 eller www.fda.gov/medwatch.
Lægemiddelinteraktioner for Cefotan
Stigninger i serumkreatinin er forekommet, da Cefotan ™ blev givet alene. Hvis Cefotan ™ og et aminoglycosid anvendes samtidig nyrefunktion, skal man omhyggeligt mo nitoreres, fordi nefrotoksicitet kan styrkes.
Interaktioner om lægemiddel/laboratorieprøve
Administrationen af Cefotan ™ kan resultere i en falsk positiv reaktion for glukose i urinen ved hjælp af Clinitest®‡ Benedict's løsning eller Fehlings løsning. Det anbefales, at glukosetest baseret på enzymatisk glukoseoxidase anvendes.
Som med andre cephalo -spo -skylning kan høje koncentrationer af cefotetan forstyrre måling af serum- og urinkreatininniveauer ved jaffé -reaktion og producere falske stigninger i niveauerne af rapporteret kreatinin.
Advarsler for Cefotan
Før terapi med Cefotan ™ indføres omhyggelig undersøgelse for at bestemme, om patienten har haft tidligere overfølsomhedsreaktioner på cefotetan -disodium cephalosporiner penicilliner eller andre lægemidler. Hvis dette produkt skal gives til penicillin-følsomme patienter, skal der udøves advarsel om, at tværhypersensitivitet blandt beta-lactam-antibiotika tydeligt er dokumenteret og kan forekomme hos op til 10% af patienterne med en historie med penicillinallergi. Hvis der forekommer en allergisk reaktion på Cefotan ™, afbryder lægemidlet. Alvorlige akutte overfølsomhedsreaktioner kan kræve behandling med epinephrin og andre nødforanstaltninger, herunder ilt intravenøse væsker intravenøse antihistaminer kortikosteroider pressoraminer og luftvejsstyring som klinisk indikeret.
En immunmedieret hæmolytisk anæmi er blevet observeret hos patienter, der modtager cephalosporin -klasse antibiotika. Der er rapporteret om alvorlige tilfælde af hæmolytisk anæmi, herunder dødsfald i forbindelse med administrationen af cefotetan. Sådanne rapporter er usædvanlige. Der ser ud til at være en øget risiko for at udvikle hæmolytisk anæmi på cefotetan i forhold til andre cephalosporiner på mindst 3 gange. Hvis en patient udvikler anæmi når som helst inden for 2 til 3 uger efter administrationen af cefotetan, skal diagnosen af en cephalosporin -associeret anæmi overvejes, og lægemidlet stoppes, indtil etiologien er bestemt med sikkerhed. Blodtransfusioner kan betragtes som nødvendigt (se Kontraindikationer ).
Patienter, der modtager kurser i cefotetan til behandling eller profylakse af infektioner, skal have periodisk overvågning for tegn og symptomer på hæmolytisk anæmi, herunder en måling af hæmatologiske parametre, hvor det er relevant.
Clostridium difficile Tilknyttet diarré (CDAD) er rapporteret ved anvendelse af næsten alle antibakterielle midler, herunder cefotetan og kan variere i sværhedsgrad fra mild diarré til dødelig colitis. Behandling med antibakterielle midler ændrer den normale flora i tyktarmen, der fører til overvækst af C. vanskelig.
C. vanskelig Producerer toksiner A og B, der bidrager til udviklingen af CDAD. Hypertoxinproducerende stammer af C. vanskelig Årsag øget sygelighed og dødelighed, da disse infektioner kan være ildfaste over for antimikrobiel terapi og kan kræve kolektomi. CDAD skal overvejes hos alle patienter, der præsenterer med diarré efter antibiotisk brug. Omhyggelig medicinsk historie er nødvendig, da CDAD er rapporteret at forekomme over to måneder efter administration af antibakterielle midler.
Hvis CDAD is suspected or co nfirmed ongoing antibiotic use not directed against C. vanskelig kan være nødvendigt at afbryde. Passende væske- og elektrolytstyringsproteintilskud Antibiotikabehandling af C. vanskelig og surgical evaluation should be instituted as clinically indicated.
Til fælles med mange andre bredspektrede antibiotika kan Cefotan ™ være forbundet med et fald i protrombinaktivitet og muligvis efterfølgende blødning. Disse ved øget risiko inkluderer patienter med nyre- eller hepatobiliær svækkelse eller dårlig ernæringstilstand de ældre og patienter med kræft.
Prothrombin -tid skal overvåges, og EXO -genøs vitamin K administreres som angivet.
Forholdsregler for Cefotan
Generel
Det er usandsynligt, at ordinering af Cefotan ™ i mangel af påvist eller stærkt mistænkt bakterieinfektion eller en profylaktisk indikation vil give fordel for patienten og øger risikoen for udviklingen af lægemiddelresistente bakterier.
Som med andre bredspektrede antibiotika kan forlænget brug af Cefotan ™ resultere i overvækst af ikke-optagelige organismer. Omhyggelig observation af patienten er vigtig. Hvis superinfektion forekommer under terapi, skal der træffes passende foranstaltninger.
Cefotan ™ skal bruges med forsigtighed hos personer med en historie med gastrointestinal sygdom, især colitis.
Karcinogenese mutagenese nedskrivning af fertilitet
Selvom langtidsundersøgelser hos dyr ikke er blevet udført for at evaluere kræftfremkaldende potentiale, blev der ikke fundet noget mutagen potentiale for cefotetan i standardlaboratorieundersøgelser.
Cefotetan har negative påvirkninger på testiklerne af prepubertal rotter. Subkutan administration af 500 mg/kg/dag (ca. 0,8 gange den maksimale voksne menneskelige dosis på kropsoverfladeareal) på dag 6 til 35 i livet (menes at være udviklingsmæssigt analog til sen barndom og præpuberty hos mennesker) resulterede i reduceret testikulær vægt og seminifero US Tubule degeneration i 10 af 10 dyr. Påvirkede celler inkluderede spermatogoni og spermato -cytes; Sertoli- og Leydig -celler blev ikke påvirket. Forekomst og sværhedsgrad af Lesio NS var dosisafhængig; Ved 120 mg/kg/dag (0,2 gange den maksimale humane dosis på kropsoverfladeareal) blev kun 1 ud af 10 behandlede dyr påvirket, og graden af deg -energi var mild.
Lignende lesio ns er blevet observeret i eksperimenter med co-parabelt design med andre methylthiotetrazo le-co ntaining antibiotika og nedsat fertilitet er rapporteret især ved høje dosisniveauer. Der blev ikke observeret nogen testikeleffekter hos 7-ugers-O LD-rotter behandlet med op til 1000 mg/kg/dag subkutan i 5 uger eller hos spædbarnshunde (3 uger gamle), der modtog op til 300 mg/kg/dag intravenøs i 5 uger (begge 1,6 gange den maksimale anbefalede humane dosis på en kropsoverfladearealbasis). Relevansen af disse fund for mennesker er ukendt.
Graviditet
Teratogene effekter
Graviditet Category B
Der er dog ingen tilstrækkelige og godt kontrollerede studier hos gravide kvinder. Fordi dyreproduktionsundersøgelser ikke altid er forudsigelige for menneskelig respons, skal dette lægemiddel kun bruges under graviditet, hvis det er klart nødvendigt.
Reproduktionsundersøgelser er blevet udført i rotter og aber i doser op til 2000 og 600 mg/kg/dag (3 og 2 gange den maksimale anbefalede humane dosis på henholdsvis en kropsoverfladeareal) og har ikke afsløret noget bevis for nedsat fertilitet eller skade på fosteret på grund af cefotetan.
Sygeplejerske mødre
Cefotetan udskilles i human mælk i meget lave koncentrationer. Der skal udvises forsigtighed, når Cefotetan administreres til en sygeplejekvinde.
Pædiatrisk brug
Sikkerhed og effektivitet hos pædiatriske patienter er ikke etableret.
Geriatrisk brug
Af de 925 forsøgspersoner, der modtog cefotetan i kliniske studier, var 492 (53%) 60 år og ældre, mens 76 (8%) var 80 år og ældre. Der blev ikke observeret nogen samlede forskelle i sikkerhed eller effektivitet mellem disse forsøgspersoner og yngre forsøgspersoner, og de andre rapporterede kliniske erfaringer har ikke identificeret forskelle i svar mellem ældre og yngre patienter, men større følsomhed for, så jeg ældre personer kan ikke udelukkes.
Det er kendt, at dette lægemiddel er væsentligt udskilt af nyrerne, og risikoen for toksiske reaktioner på dette lægemiddel kan være større hos patienter med nedsat nyrefunktion. Fordi ældre patienter sandsynligvis vil have nedsat nyrefunktion, skal man være i dosisudvælgelse, og det kan være nyttigt at overvåge nyrefunktionen (se Dosering og administration Nedsat nyrefunktion ).
Overdoseringsoplysninger til Cefotan
Oplysninger om overdosering med Cefotan ™ hos mennesker er ikke tilgængelige. Hvis overdosering skulle forekomme, skal det behandles sympto matisk, og han modialyse betragtes som især hvis nyrefunktionen kompromitteres.
Kontraindikationer for Cefotan
Cefotan ™ er kontraindiceret hos patienter med en kendt allergi mod cephalosporin -gruppen af antibiotika og hos de individer, der har oplevet en cephalosporin -associeret hæmolytisk anæmi.
Klinisk farmakologi for Cefotan
Høje plasmaniveauer af cefotetan opnås efter intravenøs og intramuskulær administration af enkeltdoser til normale frivillige.
Plasmakoncentrationer efter 1 gram intravenøs a Eller intramuskulær dosis gennemsnitlig plasmakoncentration (MCG/ML)
| Tid efter injektion | |||||||
| Rute | 15 min | 30 min | 1 h | 2 timer | 4 h | 8 timer | 12 timer |
| Iv | 92 | 158 | 103 | 72 | 42 | 18 | 9 |
| I | 34 | 56 | 71 | 68 | 47 | 20 | 9 |
| a 30-minutters infusion |
Plasmakoncentrationer efter 2 gram intravenøsa Eller intramuskulær dosis gennemsnitlig plasmakoncentration (MCG/ML)
| Tid efter injektion | |||||||
| Rute | 5 min | 10 min | 1 h | 3 timer | 5 timer | 9 timer | 12 timer |
| Iv | 237 | 223 | 13 | 74 | 48 | 22 | 12b |
| I | — | 20 | 75 | 91 | 69 | 33 | 19 |
| a Injiceret over 3 minutter b Koncentrationer estimeret fra regressionslinjen |
Gentagen administration af Cefotan ™ resulterer ikke i ophobning af lægemidlet hos normale forsøgspersoner.
Fordeling
Cefotetan er 88% plasmaprotein bundet.
Terapeutiske koncentrationer af cefotetan opnås i mange kropsvæv og væsker, herunder:
| hud | ureter |
| muskel | blære |
| fedt | Maxillær sinusslimhinde |
| Myo Metrium | mandel |
| Slut Metri | endog |
| Cervix | Peritoneal væske |
| æggestokk | Umbilical Cord Serum |
| nyre | fostervand |
Metabolisme og udskillelse
Plasma eliminatio n halveringstid for cefotetan er 3 til 4,6 timer efter enten intravenøs eller intramuskulær administration.
Ingen aktive metabolitter af cefotetan er blevet påvist; Imidlertid kan små mængder (mindre end 7%) cefotetan i plasma og urin omdannes til dens tautomer, der har antimikrobiel aktivitet svarende til moderlægemidlet.
Hos normale patienter fra 51% til 81% af en administreret dosis af Cefotan ™ udskilles uændret af nyrerne over en 24-timers periode, hvilket resulterer i høje og langvarige urinkoncentrationer. Efter intravenøse doser på 1 gram og 2 gram urinkoncentrationer er højest i løbet af den første time og når koncentrationer på henholdsvis ca. 1700 og 3500 mcg/ml.
Specifikke populationer
Patienter med nedsat nyrefunktion
Hos frivillige med reduceret nyrefunktion forlænges plasma-halveringstiden for cefotetan. Den gennemsnitlige terminale halveringstid øger ases med faldende nyrefunktion fra ca. 4 timer i frivillige med normal nyrefunktion til ca. 10 timer hos dem med moderat nyrefunktion. Der er en lineær sammenhæng mellem den systemiske clearance af cefotetan og creatinine clearance. Når nyrefunktion er nedsat, skal der anvendes en reduceret doseringsplan baseret på kreatininklarering (se Dosering og administration ).
Geriatriske patienter
In pharmacokinetic studies of eight elderly patients (greater than 65 years) with normal renal function and six healthy volunteers (aged 25 to 28 years) mean±SD) Total Body Clearance (1.8±0.1 vs. 1.8±0.3 L/h) and mean±SD Vo lume of Distribution (10.4±1.2 vs. 10.3±1.6 L) were similar fo llo wing administration of a one gram intravenous bolus dosis.
Mikrobiologi
Handlingsmekanisme
Cefotetan er et bakteriedræbende middel, der virker ved inhibering af bakteriecellevægssyntese. Cefotetan har aktivitet i nærvær af nogle beta-lactamaser både penicillinaser og cephalosporinaser af gram-negative og gram-positive bakterier.
Modstand
Modstand to cefotetan is primarily through hydrolysis by some beta-lactamases alteration of penicillin –binding proteins (PBPs) og decreased permeability.
Antimikrobiel aktivitet
Cefotetan har vist sig at være aktiv mod de fleste isolater af følgende mikroorganismer både in vitro og i kliniske infektioner (se Indikationer Og brug ).
Gram -negativ -bakterier
De udstillede chill
Haemophilus influenzae
Klebsiella arter (inklusive K. pneumoniae )
Morganella Morganies
Neisseria Gonorrhoeae
Proteus vidunderligt
Proteus vulgaris
Rettgeri Providence
Serratia marcescens
Gram-positive bakterier
Staphylococcus aureus (kun methicillin-følsomme isolater)
Staphylococcus epidermidis (kun methicillin-følsomme isolater)
Streptococcus agalactiae
Streptococcus pneumoniae
Streptococcus pyogenes
Streptococcus arter
Anaerobes
Prevotella Bivia
Prevotella disiens
Bacteroides fragilis
Prevotella melaninogenica
Bacteroides almindelige
Fusobacterium arter
Clostridium arter
Peptococcus Niger
Peptostreptococcus arter
Følgende in vitro -data er tilgængelige, men deres kliniske betydning er ukendt. Mindst 90 procent af de følgende bakterier udviser en in vitro -minimum inhiberende koncentration (MIC) mindre end eller lig med det modtagelige breakpoint for cefotetan mod isolater af lignende slægt eller organisme -gruppe. Effektiviteten af Cefotetan til behandling af kliniske infektioner forårsaget af disse bakterier er imidlertid ikke blevet fastlagt i tilstrækkelige og godt kontrollerede kliniske forsøg.
Fordele ved slangeolie til hud
Gram-negative bakterier
Citrobacter arter (inklusive C. Koseri og C. Freundii )
Moraxella Catarrhalis
Salmonella arter
Serratia arter
Shigella arter
Yersinia Enterocolitica
Anaerobes
Porphyromonas asaccharolytica
Prevotella oralis
Bacteroides splanchnicus
Propionibacterium arter
Veillonella arter
Metoder for følsomhedstest
Når det er tilgængeligt, skal det kliniske mikrobiologiske laboratorium give de kumulative rapporter om in vitro-følsomhedstestresultater for antimikrobielle lægemidler, der bruges i lokale hospitaler og praksisområder som periodiske rapporter, der beskriver følsomhedsprofilen for nosokomiale og samfunds-erhvervede patogener. Disse rapporter skal hjælpe lægen med at vælge et passende antibakterielt lægemiddel til behandling.
Fortyndingsteknikker
Kvantitative metoder bruges til at bestemme antibakterielle mikrofoner. Disse MIC'er tilvejebringer estimater af bakteriers følsomhed over for antimikrobielle forbindelser. MIC'erne skal bestemmes ved hjælp af en standardiseret procedure (bouillon eller agar)14. MIC -værdierne skal fortolkes i henhold til kriterier, der er angivet i tabel 1.
Teknisk formidling
Kvantitative metoder, der kræver mig til asurement af zonediametre, tilvejebringer også reproducerbare estimater af bakteriers følsomhed over for antimikrobielle forbindelser. Zonestørrelsen skal bestemmes ved hjælp af en standardiseret testmetode 24. Denne procedure bruger papirdiske imprægneret med 30 mcg cefotetan til at teste følsomheden af mikroorganismer over for cefotetan. Diskdiffusionstolkningskriterierne findes i tabel 1.
Anaerobe teknikker
For anaerobe bakterier kan modtageligheden for cefotetan som mikrofoner bestemmes ved standardiserede testmetoder 34. De opnåede MIC -værdier skal fortolkes i henhold til følgende kriterier:
Tabel 1: Modtagelighedstest fortolkende kriterier for cefotetan
| Mikroorganismer1 | Minimum inhiberende koncentration (MCG/ML) | ||
| S | I | R | |
| Anaerobes | ≤4 | 8 | ≥16 |
| Enterobacteriaceae | ≤4 | 8 | ≥16 |
| Haemophilus influenzae | ≤4 | 8 | ≥16 |
| Neisseria Gonorrhoeae | ≤4 | 8 | ≥16 |
| 1 Modtagelighedstolkningskriterier for mikroorganismer er baseret på et doseringsregime på 2 g hver 12. time 2 For Staphylococcus spp. Modtagelighed over for cefotetan kan udledes fra at teste penicillin og enten oxacillin eller cefoxitin. Staphylococci Modtagelig oxacillin eller cefoxitin kan betragtes som modtagelig for cefotetan. 3 For non-meningitis Streptococcus pneumoniae Isolater Modtagelighed over for penicillin (MIC mindre end 0,06 mcg/ml eller oxacillin zonediameter større end 20 mm) kan forudsige modtagelighed for cefotetan 4for beta-hemolytisk streptococci (inklusive S. Pyogenes og St. Agalactiae ) Isolater, der er modtagelige for penicillin (mikrofon mindre end 0,12 mcg/ml), kan betragtes som modtagelig for cefotetan |
En rapport om Modtagelig Angiver, at antibakteriel sandsynligvis vil hæmme væksten af patogenet, hvis det antibakterielle lægemiddel når koncentrationerne, der normalt kan opnås på infektionsstedet. En rapport om Mellemliggende Angiver, at resultatet skal samles tvetydigt, og hvis mikroen anisme ikke er fuldt ud modtagelig for alternative c linisk gennemførlige lægemidler, skal testen gentages. Denne kategori implies mulige kliniske anvendeligheder på kropssteder, hvor lægemidlet er fysiologisk koncentreret eller i situationer, hvor høj dosering af lægemiddel kan bruges. Denne kategori giver også en bufferzone, der forhindrer små ukontrollerede tekniske faktorer i at forårsage større diskpanser i fortolkningen. En rapport om Modstandsdygtig indikerer, at det antibakterielle lægemiddel ikke sandsynligvis vil hæmme væksten af patogenet, hvis det antibakterielle lægemiddel når koncentrationerne, der normalt kan opnås på infektionsstedet; Anden terapi skal vælges.
Kvalitetskontrol
Standardiserede følsomhedstestprocedurer kræver anvendelse af laboratoriekontroller for at overvåge og sikre nøjagtigheden og præcisionen af forsyninger og reagenser, der anvendes i analysen og teknikkerne for de personer, der udfører testen.1234 Standard cefotetan -pulver skal tilvejebringe følgende interval af MIC -værdier, der er anført i tabel 2.. For diffusionsteknikken ved anvendelse af 30 mcg -disken skal kriterierne i tabel 2 opnås.
Tabel 2: Acceptabel kvalitetskontrolintervaller for cefotetan
| QC -stamme | Minimal hæmmende koncentration (MCG/ML) | Zone Diameter (MM) | Agarfortynding (MCG/ML) |
| De udstillede chill ATCC 25922 | 0,06 - 0,25 | 28 - 34 | |
| Neisseria Gonorrhoeae ATCC 49226 | - | 30 - 36 | 0,5 - 2 |
| Staphylococcus aureus ATCC 25923 | - | 17 - 23 | - |
| Staphylococcus aureus ATCC 29213 | 4 - 16 | - | - |
| Bacterioides fragilis ATCC 25285 | 1 - 8 | - | 4 - 16 |
| Bacterioides thetaiotaomicron ATCC 29741 | 16 - 128 | - | 32 - 128 |
| Eggerthella Lenta ATCC 43055 | 16 - 64 | - | 32 - 128 |
Referencer
1. Clinical and Laboratory Standards Institute (CLSI). Metoder til fortynding af antimikrobielle følsomhedstest for bakterier, der vokser aerobt; Godkendt standard - tiende udgave. CLSI-dokument M07-A10 [2015] Clinical and Laboratory Standards Institute 950 West Valley Road Suite 2500 Wayne Pennsylvania 19087 USA.
2. National Committee for Clinical Laboratory Standards. Præstationsstandarder for antimikrobielDiskfølsomhedstest -Fiftende udgave. Godkendte standard NCCL'er Do Cument M2-A5 Vol. 13 Nr. 24 NCCLS Villanova PA december 1993 Clinical and Laboratory Standards Institute (CLSI). Præstationsstandarder for antimikrobiel Disk Diffusion Susceptibility Tests; Approved Stogard – Twelfth Edition. CLSI-dokument M02-A12 [2015] Clinical and Laboratory Standards Institute 950 West Valley Road Suite 2500 Wayne Pennsylvania 19087 USA.
3. Clinical and Laboratory Standards Institute (CLSI). Metoder til antimikrobiel følsomhedstest af anaerobe bakterier; Godkendt standard - ottende udgave. CLSI-dokument M11-A8 [2012]. Clinical and Laboratory Standards Institute 950 West Valley Road Suite 2500 Wayne Pennsylvania 19087 USA.
4. Clinical and Laboratory Standards Institute (CLSI). Præstationsstandarder for antimikrobiel Susceptibility Testing; Twenty-seventh Informational Supplement CLSI-dokument M100-S27 [2017] Clinical and Laboratory Standards Institute 950 West Valley Road Suite 2500 Wayne Pennsylvania 19087 USA.
Patientinformation til Cefotan
Diarré er et almindeligt problem forårsaget af antibiotika, som normalt slutter, når antibiotikumet afbrydes. Undertiden efter start af behandling med antibiotika kan patienter udvikle vandige og blodige afføring (med eller uden mavekramper og feber), selv så sent som to eller flere måneder efter at have taget den sidste dosis af antibiotikumet. Hvis dette forekommer, skal patienter kontakte deres læge så hurtigt som muligt.
Patienter skal rådes om, at antibakterielle lægemidler inklusive Cefotan ™ kun skal bruges til behandling af bakterieinfektioner. De behandler ikke virusinfektioner (f.eks. Koldkølelsen). Når Cefotan er ordineret til behandling af en bakterieinfektion, skal patienterne siges, at selv om det er almindeligt at føle sig bedre tidligt i behandlingen, skal medicinen tages nøjagtigt som anført. Spring over doser eller ikke gennemførelse af det fulde terapiforløb kan (1) mindske den effektive ness for den øjeblikkelige behandling og (2) øge sandsynligheden for, at bakterier vil udvikle resistens og ikke kan behandles med Cefotan ™ (cefotetan for injektion USP) eller andre antibakterielle lægemidler i fremtiden.
Som med så mig andre cephalo spo skyller en disulfiram-lignende reaktion, der er kendetegnet ved at skylle svedende hovedpine og takykardi, kan forekomme, når alkohol (ølvin osv.) Indtages inden for 72 timer efter Cefotan ™ (cefotetan til injektions USP) administration. Patienter skal advares om indtagelse af alkoholholdige drikkevarer efter administration af Cefotan ™.