Campath
Oplysningerne På Webstedet Er Ikke Medicinsk Rådgivning. Vi Sælger Ikke Noget. Nøjagtigheden Af Oversættelsen Er Ikke Garanteret. Ansvarsfraskrivelse
Resume af lægemiddeloversigt
Hvad er Campath?
Campath (alemtuzumab) er et antistof fremstillet af dyre -DNA, der anvendes til behandling af kronisk lymfocytisk leukæmi. Campath gives normalt, efter at andre medicin er blevet prøvet uden vellykket behandling.
Hvad er bivirkninger af Campath?
Campath kan forårsage alvorlige bivirkninger, herunder:
- elveblest
- Besvær
- Hævelse af dine ansigtslæber tunge eller hals
- feber
- kulderystelser
- kvalme
- Lightheadedness
- udslæt
- hvæsende
- brystsmerter
- Problemer med taletænkning vision eller muskelbevægelse
- Let blå mærker
- Usædvanlig blødning
- lilla eller røde pletter under din hud
- Mundsår
- Hudsår
- ondt i halsen
- hoste
- Bleg eller gulnet hud
- Mørk farvet urin
- forvirring
- usædvanlig svaghed
- åndenød
- Kolde hænder og fødder
- Hævelse i dine underben
- vægtøgning
- Tab af appetit
- pludselig smerte i din mave eller ryg og
- urin, der ser lyserød ud brun eller skummende
Få medicinsk hjælp med det samme, hvis du har nogen af de symptomer, der er anført ovenfor.
Almindelige bivirkninger af Campath inkluderer:
- feber
- kulderystelser
- svimmelhed
- Muskelstivhed
- led eller muskelsmerter
- kvalme
- opkast
- Tab af appetit
- mavesmerter
- hovedpine
- diarre
- udslæt or itching
- elveblest
- træthed
- Søvnproblemer (søvnløshed)
- angst
- træthed
- hoste
- sved eller
- Problemer med at trække vejret under eller efter infusionen.
Disse bivirkninger forekommer oftere i løbet af den første uge af behandlingen med Campath. Fortæl din læge, hvis du har alvorlige bivirkninger af Campath, herunder:
- åndenød
- Mental/humørændringer (såsom depression angst)
- knogler eller Rygsmerter
- Muskelspasme
- usædvanlig svaghed
- Hævende ankler eller fødder
- Gulende hud eller øjne
- Ændringer i mængden af urin
- smertefuld vandladning
- lyserød eller blodig urin
- følelsesløshed eller prikken af våben eller ben eller
- Smerter/rødme/hævelse af våben/ben/injektionssted.
Søg medicinsk behandling eller ring 911 på én gang, hvis du har følgende alvorlige bivirkninger:
- Alvorlige øjensymptomer såsom pludseligt synstab sløret synet tunnel vision øje smerter eller hævelse eller at se haloer omkring lys;
- Alvorlige hjertesymptomer såsom hurtig uregelmæssige eller bankende hjerteslag; flagrende i brystet; åndenød; og pludselig svimmelhed letthed eller udlevering;
- Alvorlig hovedpine forvirring sløret talearm eller ben svaghed problemer med at gå tab af koordination føles ustabil meget stive muskler høj feber voldsom sved eller rysten.
Dette dokument indeholder ikke alle mulige bivirkninger, og andre kan forekomme. Kontakt din læge for yderligere oplysninger om bivirkninger.
Dosering til Campath
Campath -medicin gives intravenøst under lægeovervågning normalt over 2 timer. Dosering er baseret på patientens respons på behandling. Patienter startes normalt med en lav dosis af medicinen, og dosis kan langsomt øges.
Hvilke stoffer stoffer eller kosttilskud interagerer med Campath?
Andre stoffer kan påvirke Campath. Fortæl din læge om al recept og medicin, du bruger. Dette inkluderer vitaminer mineraler urteprodukter og stoffer, der er ordineret af andre læger. Start ikke med at bruge en ny medicin uden at fortælle din læge.
Hvad er stærkere oxycodon eller hydrocodon
Campath under graviditet og amning
Under graviditet skal Campath kun bruges, når det er ordineret. Det anbefales, at mænd og kvinder, der modtager denne medicin, bruger mindst 2 former for fødselsbekæmpelse (f.eks. Kondomer til fødselskontrol) under behandling med denne medicin og i mindst 6 måneder bagefter. Det vides ikke, om dette stof passerer til modermælk. På grund af den mulige risiko for spædbarnets amning, mens dette lægemiddel ikke anbefales under behandling med denne medicin og i mindst 3 måneder bagefter.
Yderligere oplysninger
Vores Campath (Alemtuzumab) bivirkninger Drug Center giver et omfattende overblik over tilgængelige lægemiddelinformation om de potentielle bivirkninger, når du tager denne medicin.
FDA -lægemiddelinformation
- Lægemiddelbeskrivelse
- Indikationer
- Bivirkninger
- Advarsler
- Overdosis
- Klinisk farmakologi
- Medicin vejledning
ADVARSEL
Cytopenias infusionsreaktioner og infektioner
Cytopenier
Alvorlig inklusive dødelig pancytopeni/marv hypoplasia autoimmun idiopatisk thrombocytopeni og autoimmun hæmolytisk anæmi kan forekomme hos patienter, der får campath. Enkelt doser af Campath større end 30 mg eller kumulative doser større end 90 mg pr. Uge øger forekomsten af pancytopeni [se advarsler og FORHOLDSREGLER ].
Infusionsreaktioner
Campath -administration kan resultere i alvorlige, herunder dødelige infusionsreaktioner. Overvåg forsigtigt patienter under infusioner og tilbageholdt Campath for grad 3 eller 4 infusionsreaktioner. Escalerer Campath gradvist til den anbefalede dosis ved påbegyndelse af terapi og efter afbrydelse af terapi i 7 eller flere dage [se Dosering og administration og advarsler og FORHOLDSREGLER ].
Infektioner
Alvorlig inklusive dødelig bakteriel viral svampe- og protozoaninfektioner kan forekomme hos patienter, der får Campath. Administrer profylakse mod pneumocystis jiroveci lungebetændelse (PCP) og herpesvirusinfektioner [se Dosering og administration og advarsler og FORHOLDSREGLER ].
Beskrivelse for Campath
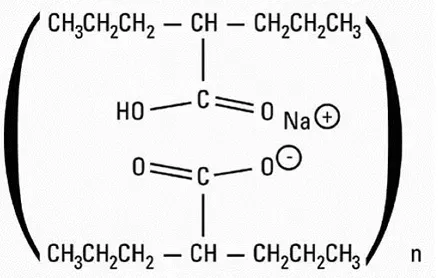
Campath (alemtuzumab) er en rekombinant DNA-afledt humaniserede monoklonale antistof (Campath-1H) rettet mod 21-28 KD celleoverflade glycoprotein CD52. Campath-1H er et IgG1 Kappa-antistof med human variabel ramme og konstante regioner og komplementaritetsbestemmende regioner fra et murint (rotte) monoklonalt antistof (Campath-1g). Campath-1H-antistoffet har en omtrentlig molekylvægt på 150 kD. Campath er produceret i pattedyrcelle (kinesisk hamster æggestokkens ophængskultur i et medium indeholdende neomycin. Neomycin kan ikke påvises i det endelige produkt.
Campath er en steril klar farveløs isotonisk opløsning (pH 6,8–7,4) til injektion. Hvert engangs hætteglas af campath indeholder 30 mg alemtuzumab 8,0 mg natriumchlorid 1,44 mg dibasisk natriumphosphat 0,2 mg kaliumchlorid 0,2 mg monobasisk kaliumphosphat 0,1 mg polysorbat 80 og 0,0187 mg Disodium Ednetat dihydrat. Ingen konserveringsmidler tilsættes.
Anvendelser til Campath
Campath er indikeret som et enkelt middel til behandling af B-celle kronisk lymfocytisk leukæmi (B-CLL).
Dosering til Campath
Doseringsplan og administration
- Administrer som en intravenøs infusion over 2 timer. Administrer ikke som intravenøs skub eller bolus.
- Anbefalet doseringsregime
- Escalere gradvist til den maksimale anbefalede enkelt dosis på 30 mg. Optrapping er påkrævet ved initiering af dosering, eller hvis dosering holdes ≥7 dage under behandlingen. Optrapping til 30 mg normalt kan opnås om 3 til 7 dage.
- Optrappestrategi
- Administrer 3 mg dagligt, indtil infusionsrelaterede reaktioner er ≤ grad 2 [se Bivirkninger ].
- Administrer derefter 10 mg dagligt, indtil infusionsrelaterede reaktioner er ≤ grad 2.
- Administrer derefter 30 mg/dag tre gange om ugen på alternative dage (f.eks. Man-wed-fre). Den samlede varighed af terapi inklusive dosisoptrapning er 12 uger.
- Enkelt doser på mere end 30 mg eller kumulative doser større end 90 mg pr. Uge øger forekomsten af pancytopeni.
Anbefalede samtidig medicin
- Præmedikat med diphenhydramin (50 mg) og acetaminophen (500-1000 mg) 30 minutter før første infusion og hver dosisoptrapning. Institut passende medicinsk styring (f.eks. Glukokortikoider epinephrin meperidin) til infusionsrelaterede reaktioner efter behov [se ADVARSELS AND FORHOLDSREGLER og Bivirkninger ].
- Administrer trimethoprim/sulfamethoxazol dobbeltstyrke (DS) to gange dagligt 3 gange om ugen (eller tilsvarende) som pneumocystis jirovecii lungebetændelse (PCP) profylakse.
- Administrer famciclovir 250 mg bud eller tilsvarende som herpetisk profylakse.
Fortsæt PCP og herpes viral profylakse i mindst 2 måneder efter afslutningen af Campath, eller indtil CD4 -tællingen er ≥200 celler/μl, alt efter hvad der opstår senere [Se ADVARSELS AND FORHOLDSREGLER ].
Doseringsmodifikation
- Tilbageholde Campath under alvorlig infektion eller andre alvorlige bivirkninger indtil opløsningen.
- Afbryd Campath for autoimmun anæmi eller autoimmun thrombocytopeni.
- Der anbefales ingen dosismodifikationer til lymfopeni.
Dosismodifikation for neutropeni eller thrombocytopeni [se advarsler og forholdsregler]
| Hæmatologiske værdier | Doseringsmodifikation* |
| ANC <250/μL og/or platelet count ≤25000/μL | |
| For første forekomst: | Tilbageholde Campath -terapi. Genoptag Campath ved 30 mg, når ANC ≥500/μL og blodpladetælling ≥50000/μL. |
| Til anden forekomst: | Tilbageholde Campath -terapi. Genoptag Campath ved 10 mg, når ANC ≥500/μL og blodpladetælling ≥50000/μL. |
| For tredje forekomst: | Afbryd Campath -terapi. |
| > 50% fald fra baseline hos patienter, der initierer terapi med en baseline ANC ≤250/μl og/eller en baseline -blodpladeantal ≤ 25000/μl | |
| For første forekomst: | Tilbageholde Campath -terapi. Genoptag Campath ved 30 mg ved tilbagevenden til baselineværdien (r). |
| Til anden forekomst: | Tilbageholde Campath -terapi. Genoptag Campath ved 10 mg ved tilbagevenden til baselineværdien (er). |
| For tredje forekomst: | Afbryd Campath -terapi. |
| * Hvis forsinkelsen mellem dosering er ≥7 dage, skal du starte terapi ved Campath 3 mg og eskalere til 10 mg og derefter til 30 mg som tolereret [se Dosering og administration ]. |
Forberedelse og administration
Parenterale lægemiddelprodukter skal inspiceres visuelt for partikler og misfarvning inden administration. Hvis partikler er til stede, eller opløsningen er misfarvet, skal du kaste hætteglasset. Ryst ikke hætteglas.
Brug aseptisk teknik under forberedelse og administration af Campath. Træk den nødvendige mængde Campath tilbage fra hætteglasset i en sprøjte.
- For at fremstille den 3 mg dosis trækker 0,1 ml ud i en 1 ml sprøjte kalibreret i trin på 0,01 ml.
- For at fremstille 10 mg dosis trækker 0,33 ml ud i en 1 ml sprøjte kalibreret i trin på 0,01 ml.
- For at fremstille 30 mg -dosis tilbagetrækning 1 ml i enten en 1 ml eller 3 ml sprøjte kalibreret i trin på 0,1 ml.
Injektionssprøjteindhold i 100 ml steril 0,9% natriumchlorid USP eller 5% dextrose i vand USP. Inverter forsigtigt posen for at blande opløsningen. Kasser sprøjte.
Hætteglasset indeholder ingen konserveringsmidler og er kun beregnet til engangsbrug. Kasser hætteglas inklusive enhver ubrugt del efter tilbagetrækning af dosis.
Hvor ofte tager du Fosamax
Brug inden for 8 timer efter fortynding. Opbevaret fortyndet campath ved stuetemperatur mellem 15 ° C til 30 ° C (59 ° F til 86 ° F) eller kølet ved 2 ° C til 8 ° C (36 ° F til 46 ° F). Beskyt mod lys.
Uforenelighed
Campath er kompatibel med polyvinylchlorid (PVC) poser og PVC eller polyethylenforede PVC-administrationssæt. Tilsæt ikke eller påfør samtidig andre lægemiddelstoffer gennem den samme intravenøse linje.
Hvor leveret
Doseringsformularer og styrker
Indsprøjtning : 30 mg/1 ml som en klar farveløs opløsning i hætteglas med enkelt dosis
Opbevaring og håndtering
Campath (alemtuzumab) leveres i klart glas-enkeltdosis hætteglas indeholdende 30 mg alemtuzumab i 1 ml opløsning. Hver karton indeholder tre Campath -hætteglas ( NDC 58468â0357-3) eller et Campath-hætteglas ( NDC 58468-0357-1).
Opbevar Campath ved 2 ° C til 8 ° C (36 ° F til 46 ° F). Frys ikke. Hvis ved et uheld frosset optø ved 2 ° C til 8 ° C før administration. Beskyt mod direkte sollys.
Fremstillet og distribueret af: Genzyme Corporation Cambridge MA 02142 US License Number: 1596. Revideret: Apr 2023
Bivirkninger for Campath
Følgende klinisk signifikante bivirkninger diskuteres mere detaljeret i andre sektioner af etiketten:
- Cytopenier [see ADVARSELS AND FORHOLDSREGLER ]
- Infusionsrelaterede reaktioner [se ADVARSELS AND FORHOLDSREGLER ]
- Immunsuppression/infektioner [se ADVARSELS AND FORHOLDSREGLER ]
Kliniske forsøg oplever
Fordi kliniske forsøg udføres under vidt forskellige tilstande, kan der ikke sammenlignes bivirkninger, der er observeret i de kliniske forsøg med et lægemiddel, ikke direkte med hastigheder i de kliniske forsøg med et andet lægemiddel og muligvis ikke afspejler de satser, der er observeret i praksis.
Dataene nedenfor afspejler eksponering for Campath hos 296 patienter med CLL, hvori 147 tidligere var ubehandlet og 149 modtog mindst 2 tidligere kemoterapiregimer. Den median varighed af eksponering var 11,7 uger for tidligere ubehandlede patienter og 8 uger for tidligere behandlede patienter.
De mest almindelige bivirkninger med Campath er: infusionsrelaterede reaktioner (pyrexia kulderystelser Hypotension urticaria kvalme Rash Tachycardia dyspnø) Cytopenier (Neutropenia Lymfopeni-thrombocytopenia anemia) infektioner (CMV-viremia CMV-infektionsinfektions) gastrointestinale symptomer (nausea emese emese) infektioner (CMV Viremia CMV-infektionsinfektion) gastrointestinale symptomer (nausea emese emese emdhi) infektion og neurologiske symptomer (søvnløshedsangst). De mest almindelige alvorlige bivirkninger er cytopenias-infusionsrelaterede reaktioner og immunsuppression/infektioner.
Lymfopeni
Alvorlig lymfopeni og et hurtigt og vedvarende fald i lymfocytundersæt forekom hos tidligere ubehandlede og tidligere behandlede patienter efter administration af Campath. Hos tidligere ubehandlede patienter var median CD4 0 celler/μl ved en måned efter behandling og 238 celler/μl [25% -75% interkvartilområde 115 til 418 celler/μl ved 6 måneder efter behandling [se ADVARSELS AND FORHOLDSREGLER ].
Neutropeni
Hos tidligere ubehandlede patienter var forekomsten af grad 3 eller 4 neutropeni 42% med en median tid til begyndelsen af 31 dage og en median varighed på 37 dage. Hos tidligere behandlede patienter var forekomsten af grad 3 eller 4 neutropeni 64% med en median varighed på 28 dage. Ti procent af de tidligere ubehandlede patienter og 17% af de tidligere behandlede patienter modtog granulocytkoloni stimulerende faktorer.
Anæmi
Hos tidligere ubehandlede patienter var forekomsten af grad 3 eller 4 anæmi 12% med en median tid til begyndelsen af 31 dage og en median varighed på 8 dage. Hos tidligere behandlede patienter var forekomsten af grad 3 eller 4 anæmi 38%. Sytten procent af de tidligere ubehandlede patienter og 66% af de tidligere behandlede patienter modtog enten erythropoiesis -stimulerende midler transfusioner eller begge dele.
Thrombocytopeni
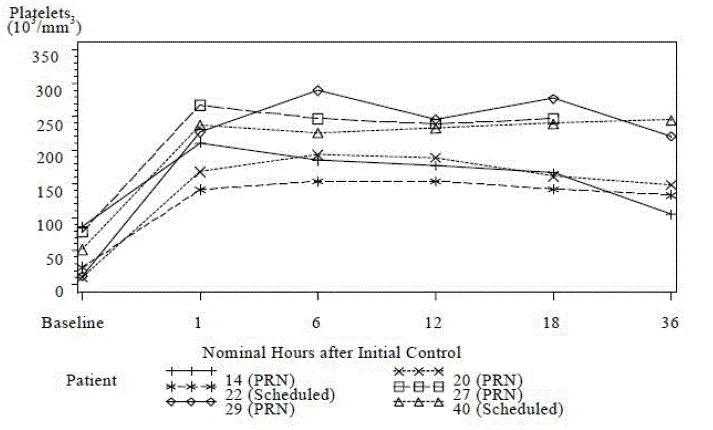
Hos tidligere ubehandlede patienter var forekomsten af grad 3 eller 4 thrombocytopeni 14% med en median tid til indtræden på 9 dage og en median varighed på 14 dage. Hos tidligere behandlede patienter var forekomsten af grad 3 eller 4 thrombocytopeni 52% med en median varighed på 21 dage. Autoimmun thrombocytopeni blev rapporteret hos 2% af tidligere behandlede patienter med en dødelighed.
Infusionsrelaterede reaktioner
Infusionsrelaterede reaktioner, der omfattede pyrexia-kulderystelse Hypotension urticaria og dyspnø var almindelige. Grad 3 og 4 pyrexia og/eller kulderystelser forekom hos ca. 10% af tidligere ubehandlede patienter og hos ca. 35% af de tidligere behandlede patienter. Forekomsten af infusionsrelaterede reaktioner var størst i den første behandlingsuge og faldt med efterfølgende doser af Campath. Alle patienter blev forbehandlet med antipyretika og antihistaminer; Derudover modtog 43% af de tidligere ubehandlede patienter glukokortikoidforbehandling.
Infektioner
I undersøgelsen af tidligere ubehandlede patienter blev patienter testet ugentligt for CMV ved anvendelse af et PCR -assay fra initiering gennem afslutning af terapi og hver 2. uge i de første 2 måneder efter terapi. CMV -infektion forekom hos 16% (23/147) af tidligere ubehandlede patienter; Cirka en tredjedel af disse infektioner var alvorlige eller livstruende. I undersøgelser af tidligere behandlede patienter, hvor rutinemæssig CMV -overvågning ikke var påkrævet, blev CMV -infektion dokumenteret i 6% (9/149) af patienterne; Næsten alle disse infektioner var alvorlige eller livstruende.
Andre infektioner blev rapporteret hos ca. 50% af patienterne på tværs af alle undersøgelser. Grad 3 til 5 sepsis varierede fra 3% til 10% på tværs af undersøgelser og var højere hos tidligere behandlede patienter. Grad 3 til 4 Febrile Neutropenia varierede fra 5% til 10% på tværs af undersøgelser og var højere hos tidligere behandlede patienter. Infektionsrelaterede dødsfald forekom hos 2% af tidligere ubehandlede patienter og 16% af tidligere behandlede patienter. Der var 198 episoder af anden infektion hos 109 tidligere ubehandlede patienter; 16% var bakterielle 7% var svampe 4% var andre virale, og i 73% blev organismen ikke identificeret.
Hjerte
Hjerte dysrhythmias occurred in approximately 14% of previously untreated patients. The majority were tachycardias og were temporally associated with infusion; dysrhythmias were Grade 3 or 4 in 1% of patients.
Tidligere ubehandlede patienter
Tabel 1 indeholder udvalgte bivirkninger observeret hos 294 patienter randomiseret (1: 1) for at modtage Campath eller Chlorambucil som første linjeterapi for B-CLL. Campath blev administreret i en dosis på 30 mg intravenøst tre gange ugentligt i op til 12 uger. Den medianvarighed af terapien var 11,7 uger med en median ugentlig dosis på 82 mg (25% -75% interkvartilområde: 6990 mg).
Tabel 1: Per patientforekomst af udvalgte* bivirkninger i behandling naive B-CLL-patienter
| Campath (n = 147) | Chlorambucil (n = 147) | ||||
| Alle karakterer † % | Grad 3-4 % | Alle karakterer % | Grad 3-4 % | ||
| Blod- og lymfesystemforstyrrelser | Lymfopeni | 97 | 97 | 9 | 1 |
| Neutropeni | 77 | 42 | 51 | 26 | |
| Anæmi | 76 | 13 | 54 | 18 | |
| Thrombocytopeni | 71 | 13 | 70 | 14 | |
| Generelle lidelser og administrationsstedets forhold | Pyrexia | 69 | 10 | 11 | 1 |
| Kulderystelser | 53 | 3 | 1 | 0 | |
| Infektioner og Infestations | CMV Viremia ‡ | 55 | 4 | 8 | 0 |
| CMV -infektion | 16 | 5 | 0 | 0 | |
| Andre infektioner | 74 | 21 | 65 | 10 | |
| Hud og subkutane vævsforstyrrelser | Urticaria | 16 | 2 | 1 | 0 |
| Udslæt | 13 | 1 | 4 | 0 | |
| Erythema | 4 | 0 | 1 | 0 | |
| Vaskulære lidelser | Hypotension | 16 | 1 | 0 | 0 |
| Hypertension | 14 | 5 | 2 | 1 | |
| Nervesystemforstyrrelser | Hovedpine | 14 | 1 | 8 | 0 |
| Rysten | 3 | 0 | 1 | 0 | |
| Respiratorisk thorax- og mediastinal lidelser | Dyspnø | 14 | 4 | 7 | 3 |
| Gastrointestinale lidelser | Diarre | 10 | 1 | 4 | 0 |
| Psykiatriske lidelser | Søvnløshed | 10 | 0 | 3 | 0 |
| Angst | 8 | 0 | 1 | 0 | |
| Hjerte Disorders | Takykardi | 10 | 0 | 1 | 0 |
| * Bivirkninger, der forekommer ved en højere relativ frekvens i Campath -armen † NCI CTC version 2.0 for bivirkninger; NCI CTCAE version 3.0 til laboratorieværdier ‡ CMV -viræmi (uden bevis for symptomer) inkluderer både tilfælde af enkelt PCR -positive testresultater og af bekræftet CMV -viræmi (≥2 lejligheder i på hinanden følgende prøver på 1 uges mellemrum). For sidstnævnte blev ganciclovir (eller tilsvarende) initieret pr. Protokol. |
Tidligere behandlede patienter
Yderligere sikkerhedsoplysninger blev opnået fra 3 enkeltarmundersøgelser af 149 tidligere behandlede patienter med CLL administreret 30 mg campath intravenøst tre gange ugentligt i 4 til 12 uger (median kumulativ dosis 673 mg [område 2-1106 mg]; median varighed af terapi 8,0 uger). Bivirkninger i disse undersøgelser, der ikke var anført i tabel 1, der forekom ved en forekomst på> 5%, var træthed kvalme emesis muskuloskeletalsmerter anoreksi dysestesi slimhinde og bronchospasme.
Immunogenicitet
Som med alle terapeutiske proteiner er der potentiale for immunogenicitet. Forekomsten af antistofdannelse er meget afhængig af følsomheden og specificiteten af assayet. Derudover kan den observerede forekomst af antistof (inklusive neutraliserende antistof) positivitet i et assay påvirkes af adskillige faktorer, herunder assaymetodologi Prøvehåndteringstidspunkt for prøveopsamling Samtidig medicin og underliggende sygdom. Af disse grunde kan sammenligning af forekomsten af antistoffer med forekomsten af antistoffer mod andre alemtuzumab -produkter være vildledende.
Ved anvendelse af et ELISA-assay-anti-humane antistoffer (HAHA) blev detekteret i 11 ud af 133 (8,3%) tidligere ubehandlede patienter. Derudover var to patienter svagt positive til neutraliserende aktivitet. Begrænsede data antyder, at anti-campath-antistofferne ikke påvirkede tumorrespons negativt. Fire af 211 (1,9%) tidligere behandlede patienter viste sig at have antistoffer mod Campath efter behandling.
Oplevelse af postmarketing
Campath
Følgende bivirkninger er blevet identificeret under postapproval brug af Campath. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt at pålideligt estimere deres frekvens eller etablere et årsagsforhold til eksponering for lægemidler.
Generelle lidelser og administrationsstedets forhold: Fatal infusionsrelaterede reaktioner.
Kardiovaskulære lidelser: Kongestiv hjertesvigt kardiomyopati nedsatte ejektionsfraktionen (nogle patienter var tidligere blevet behandlet med kardiotoksiske midler).
Cerebrovaskulære lidelser: Cervicocephalic arteriel dissektionsslaget inklusive hæmoragisk og iskæmisk slagtilfælde.
Gastrointestinale lidelser: Akut akalkuløs kolecystitis.
Immunsystemforstyrrelser: Goodpastures syndrom Graves 'sygdom aplastisk anæmi Guillain-Barré-syndrom kronisk inflammatorisk demyeliniserende polyradiculoneuropati-serumsygdom dødelig transfusion Associeret Graft versus værtssygdom hæmofagocytisk lymphohistiocytose (HLH).
Infektioner: Epstein-Barr-virus (EBV) -infektion Progressiv multifokal leukoencefalopati (PML) reaktivering af latente vira.
Metabolisme og ernæringsforstyrrelser: Tumorlysissyndrom.
Neoplasmer: EBV-associeret lymfoproliferativ lidelse.
Nervesystemforstyrrelser: Optisk neuropati.
Nyre- og urinforstyrrelser: Glomerulære nefropatier.
Andre alemtuzumab -produkter
Følgende bivirkninger er blevet identificeret under postapproval brug af et andet alemtuzumab -produkt. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt at pålideligt estimere deres frekvens eller etablere et årsagsforhold til eksponering for lægemidler.
Endokrine lidelser: Hypothyreoidisme Hyperthyreoidisme og thyroiditis.
Nervesystemforstyrrelser: Autoimmun encephalitis.
Lægemiddelinteraktioner for Campath
Der er ikke udført nogen formelle lægemiddelinteraktionsundersøgelser med Campath.
Advarsler for Campath
Inkluderet som en del af FORHOLDSREGLER afsnit.
Forholdsregler for Campath
Cytopenier
Alvorlig inklusive dødelig autoimmun anæmi og thrombocytopeni og langvarig myelosuppression er rapporteret hos patienter, der modtager Campath.
Derudover er der rapporteret om hæmolytisk anæmi ren rød celle aplasia knoglemarvs aplasi og hypoplasi efter behandling med campath i den anbefalede dosis. Enkelt doser af Campath større end 30 mg eller kumulative doser større end 90 mg pr. Uge øger forekomsten af pancytopeni.
Tilbageholde Campath for alvorlige cytopenier (undtagen lymfopeni). Stop for autoimmune cytopenier eller tilbagevendende/vedvarende alvorlige cytopenier (undtagen lymfopeni) [se Dosering og administration ]. No data exist on the safety of Campath resumption in patients with autoimmune cytopenias or marrow aplasia [see Bivirkninger ].
Få komplette blodtællinger (CBC) med ugentlige intervaller under campath -terapi, og hyppigere, hvis forværring af anæmi -neutropeni eller thrombocytopeni forekommer. Vurder CD4 -tællinger efter behandling indtil opsving til ≥200 celler/μl [se Dosering og administration og Bivirkninger ].
bupropion xl 150 mg tabletter 24 timer
Infusionsrelaterede reaktioner
Bivirkninger, der forekommer under eller kort efter, at Campath -infusion inkluderer pyrexia kulderystelser/rigor kvalme hypotension urticaria dyspnea udslæt emese og bronchospasme [se Bivirkninger ]. In clinical trials the frequency of infusion-related reactions was highest in the first week of treatment. Monitor for the signs og symptoms listed above og withhold infusion for Grade 3 or 4 infusion-related reactions.
Følgende seriøse inklusive dødelige infusionsrelaterede reaktioner er blevet identificeret i postmarketingrapporter: Synkope lungeinfiltrater Akut respiratorisk nød syndrom (ARDS) Respiratorisk arrestation Cardiac Arythmias Myokardieinfarkt akut hjerteinsufficiens Cardiac arrest angioedema og anaphylactoid chok.
Initier Campath i henhold til det anbefalede dosis-eskaleringsskema [se Dosering og administration ]. Premedicate patients with an antihistamine og acetaminophen prior to each dose. Institute appropriate medical management (e.g. glucocorticoids epinephrine meperidine) for infusion-related reactions as needed [see Dosering og administration ]. If therapy is interrupted for 7 or more days reinstitute Campath with gradual dose escalation [see Dosering og administration ].
Immunsuppression/infektioner
Campath treatment results in severe og prolonged lymphopenia with a concomitant increased incidence of opportunistic infections [see Bivirkninger ]. Administer PCP og herpes viral prophylaxis during treatment with Campath og for a minimum of 2 months after completion of Campath or until the CD4+ count is ≥200 cells/μL whichever occurs later [see Dosering og administration ]. Prophylaxis does not eliminate these infections.
Overvåg rutinemæssigt patienter for CMV -infektion under behandling med Campath og i mindst 2 måneder efter afslutningen af Campath. Tilbageholde Campath for alvorlige infektioner og under antiviral behandling af CMV -infektion eller bekræftet CMV -viræmi (defineret som polymerasekædereaktion [PCR] positiv CMV i ≥2 på hinanden følgende prøver opnået 1 uges mellemrum). Initier terapeutisk ganciclovir (eller tilsvarende) til CMV -infektion eller bekræftet CMV -viræmi.
Epstein-Barr-virus (EBV) -infektion inklusive svær og dødelig EBV-associeret hepatitis er rapporteret hos patienter, der modtog Campath.
Monitor til tegn og symptomer på EBV -infektioner. Tilbageholde Campath for EBV -reaktivering eller alvorlig infektion.
Administrer kun bestrålet blodprodukter for at undgå transfusionsassocieret transplantat versus værtssygdom (TAGVHD), medmindre de nye omstændigheder dikterer øjeblikkelig transfusion.
Hos patienter, der modtog Campath som initial terapi -genopretning af CD4 -tællinger til ≥200 celler/μl, forekom 6 måneder efter afslutningen af Campath; Imidlertid efter 2 måneder efter behandling var medianen 183 celler/μl. Hos tidligere behandlede patienter, der modtog Campath, var mediantiden til bedring af CD4 -tællinger til ≥200 celler/μl 2 måneder; Imidlertid kan fuld opsving (til baseline) af CD4 og CD8 -tællinger tage mere end 12 måneder [se Bivirkninger ].
Immunisering
Sikkerheden ved immunisering med levende virale vacciner efter campath -terapi er ikke undersøgt. Administrer ikke levende virale vacciner til patienter eller spædbørn, der er født til patienter, der modtager Campath. Evnen til at generere en immunrespons på enhver vaccine efter campath -terapi er ikke undersøgt.
Ikke -klinisk toksikologi
Karcinogenese mutagenese nedskrivning af fertilitet
Undersøgelser til vurdering af det kræftfremkaldende eller genotoksiske potentiale i Campath er ikke blevet udført.
I fertilitetsundersøgelser blev alemtuzumab (3 eller 10 mg/kg intravenøst) administreret til HUCD52 transgene hanmus på 5 på hinanden følgende dage før samliv med ubehandlede vildtype-hunner. Der blev ikke observeret nogen effekt på fertilitet eller reproduktiv ydeevne. Imidlertid blev bivirkninger på sædparametre (inklusive unormal morfologi [løsrevet/intet hoved] og reduceret total antal og motilitet) observeret i begge testede doser.
Når alemtuzumab (3 eller 10 mg/kg intravenøst) blev administreret til HUCD52-transgene hunmus i 5 på hinanden følgende dage før samliv med ubehandlede vildtype-mænd, resulterede der et fald i det gennemsnitlige antal corpora-lutea og implantationssteder og en stigning i postimplantationstab, hvilket resulterede i færre gennemførte embryer ved den højere dose.
Brug i specifikke populationer
Graviditet
Risikooversigt
Baseret på fund fra dyreforsøg kan Campath forårsage føtal skade, når de administreres til en gravid kvinde. Tilgængelige data fra offentliggjorte kohortundersøgelser hos gravide kvinder er utilstrækkelige til at etablere en campath-associeret risiko for større fødselsdefekter spontanabort eller ugunstige moder- eller føtal resultater. Alemtuzumab var embryolethal i gravide HUCD52 transgene mus, når de blev administreret under organogenese (se Data ). Humane IgG -antistoffer er kendt for at krydse placentabarrieren; Derfor kan Campath overføres fra moderen til det udviklende foster. Rådgiv kvinder om den potentielle risiko for fosteret. Spædbørn født af gravide kvinder, der er behandlet med Campath, kan have en øget risiko for infektion (se Kliniske overvejelser ).
Baggrundsrisikoen for store fødselsdefekter og spontanabort for den angivne befolkning er ukendt. Alle graviditeter har en baggrundsrisiko for tab af fødselsdefekt eller andre bivirkninger. I den amerikanske generelle befolkning er den estimerede baggrundsrisiko for større fødselsdefekter og spontanabort i klinisk anerkendte graviditeter henholdsvis 2% til 4% og 15% til 20%.
Kliniske overvejelser
Føtal/neonatal bivirkninger
Monoklonale antistoffer transporteres over morkagen, når graviditeten skrider frem med det største beløb, der blev overført i tredje trimester. Overvej risikoen og fordelene ved at administrere levende eller levende dæmpede vacciner til spædbørn udsat for Campath i utero [se ADVARSELS AND FORHOLDSREGLER ].
Data
Dyredata
Når alemtuzumab blev administreret til gravide HUCD52 transgene mus under organogenese (drægtighedsdage [GD] 6-10 eller GD 11-15) ved intravenøse doser på 3 eller 10 mg/kg ingen teratogene virkninger blev observeret. Der var dog en stigning i embryoletalitet (øget tab efterimplantation og antallet af dæmninger med alle fostre døde eller resorberede) hos gravide dyr doseret under GD 11-15. I en separat undersøgelse i gravide HUCD52 transgene musadministration af alemtuzumab under organogenese (GD 6-10 eller GD 11-15) ved intravenøse doser på 3 eller 10 mg/kg fald i B-lymfocyt- og T-lymphocytpopulationer i afkom ved begge doser testet.
I gravide HUCD52 -transgene mus indgivet alemtuzumab ved intravenøse doser på 3 eller 10 mg/kg/dag gennem drægtighed og amning var der en stigning i hvalpedød i laktationsperioden ved 10 mg/kg. Fald i T-lymfocyt- og B-lymfocytpopulationer og i antistofrespons blev observeret hos afkom i begge testede doser.
Amning
Risikooversigt
Der er ingen data om tilstedeværelsen af alemtuzumab i human mælkeffekter på mælkeproduktion eller det ammede barn. Virkningerne af lokal gastrointestinal eksponering og begrænset systemisk eksponering hos det ammede spædbarn for alemtuzumab er ukendte. Alemtuzumab blev påvist i mælken med ammende HUCD52 transgene mus administreret alemtuzumab (se Data ). Maternal IgG is known to be present in human milk og when a drug is present in animal milk it is likely that the drug will be present in human milk.
På grund af potentialet for alvorlige bivirkninger fra Campath i et ammet barn inklusive reduceret lymfocyttællinger rådgiver ammende kvinder om ikke at amme under behandling med Campath og i mindst 3 måneder efter den sidste dosis.
Data
Alemtuzumab blev påvist i mælken af ammende HUCD52 transgene mus efter intravenøs indgivelse af alemtuzumab i en dosis på 10 mg/kg på postpartum dage 8-12. Serumniveauer af alemtuzumab var ens i ammende mus og afkom på postpartum dag 13 og var forbundet med bevis for farmakologisk aktivitet (fald i lymfocyttællinger) i afkom.
Kvinder og mænd med reproduktivt potentiale
Campath may cause embryo-fetal harm when administered to pregnant women [see Brug i specifikke populationer ].
Graviditet Testing
Graviditet testing is recommended for females of reproductive potential prior to initiating Campath therapy.
Svangerskabsforebyggelse
Hunner
Rådgiv kvindelige patienter om reproduktivt potentiale til at bruge effektiv prævention under behandling med Campath og i mindst 3 måneder efter den sidste dosis.
Infertilitet
Baseret på fund fra dyreforsøg kan alemtuzumab forringe fertiliteten hos kvinder og mænd med reproduktionspotentiale [se Ikke -klinisk toksikologi ]. The reversibility of the effect on fertility is unknown.
Over skranken Fastin Diet -piller
Pædiatrisk brug
Campaths sikkerhed og effektivitet er ikke etableret hos pædiatriske patienter.
Geriatrisk brug
Af 147 tidligere ubehandlede B-CLL-patienter behandlet med Campath 35% var ≥ 65 år og 4% var ≥ 75 år. På 149 tidligere behandlede patienter med B-CLL 44% var ≥65 år og 10% var ≥75 år gammel. Kliniske undersøgelser af Campath inkluderede ikke tilstrækkeligt antal forsøgspersoner 65 år og derover for at afgøre, om de reagerer anderledes end yngre emner. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle i responser mellem de ældre og yngre patienter.
Overdoseringsoplysninger til Campath
På tværs af alle kliniske erfaringer var den rapporterede maksimale modtagne enkeltdosis 90 mg. Knoglemarv Aplasia-infektioner eller alvorlige infusionsrelaterede reaktioner forekom hos patienter, der modtog en dosis højere end anbefalet.
En patient, der modtog en 80 mg dosis intravenøst oplevet akut bronchospasme hoste og dyspnø efterfulgt af anuria og død. En anden patient modtog to 90 mg doser intravenøst en dags mellemrum i løbet af den anden uge af behandlingen og oplevede en hurtig indtræden af knoglemarvs aplasi.
Der er ingen kendt specifik modgift til overdosering af campath. Afbryd Campath og sørg for støttende terapi.
Kontraindikationer for Campath
Ingen.
Klinisk farmakologi for Campath
Handlingsmekanisme
Campath binds to CD52 an antigen present on the surface of B og T lymphocytes a majority of monocytes macrophages NK cells og a subpopulation of granulocytes. A proportion of bone marrow cells including some CD34+ cells express variable levels of CD52. The proposed mechanism of action is antibody-dependent cellular-mediated lysis following cell surface binding of Campath to the leukemic cells.
Farmakodynamik
Hjerte Electrophysiology
Virkningen af flere doser af alemtuzumab (12 mg/dag i 5 dage) på QTC-intervallet blev evalueret i en enkeltarmundersøgelse hos 53 patienter uden malignitet. Ingen store ændringer i det gennemsnitlige QTC -interval (dvs.> 20 ms) blev påvist i undersøgelsen. En gennemsnitlig stigning i hjerterytme på 22 til 26 slag/min blev observeret i mindst 2 timer efter den indledende infusion af alemtuzumab. Denne stigning i hjerterytme blev ikke observeret med efterfølgende doser.
Toprol xl 25 mg bivirkninger
Farmakokinetik
Campath pharmacokinetics were characterized in a study of 30 previously treated B-CLL patients in whom Campath was administered at the recommended dose og schedule. After 12 weeks of dosing patients exhibited a 7-fold increase in mean AUC.
Fordeling
Efter de sidste 30 mg dosis var det gennemsnitlige distributionsvolumen ved stabil tilstand 0,18 L/kg (område 0,1 til 0,4 L/kg).
Eliminering
Campath pharmacokinetics displayed nonlinear elimination kinetics. Systemic clearance decreased with repeated administration due to decreased receptor-mediated clearance (i.e. loss of CD52 receptors in the periphery). Mean half-life was 11 hours (range 2 to 32 hours) after the first 30 mg dose og was 6 days (range 1 to 14 days) after the last 30 mg dose.
Specifikke populationer
Virkningerne af nyre- eller levernedsættelse af farmakokinetikken i Campath er ikke undersøgt.
Kliniske studier
Tidligere ubehandlede B-CLL-patienter
Campath was evaluated in an open-label rogomized (1:1) active-controlled study in previously untreated patients with B-CLL Rai Stage I-IV with evidence of progressive disease requiring therapy. Patients received either Campath 30 mg intravenously 3 times per week for a maximum of 12 weeks or chlorambucil 40 mg/m² orally once every 28 days for a maximum of 12 cycles.
Af de 297 patienter, der randomiserede medianalderen, var 60 år 72% var mandlige 99% var kaukasiske 96% havde en WHO-præstationsstatus 0-1 23% havde maksimal lymfeknude diameter ≥5 cm 34% var RAI fase III/IV og 8% blev behandlet i U.S.
Patienter, der er randomiseret til at modtage Campath, oplevede længere progressionsfri overlevelse (PFS) sammenlignet med dem, der er randomiseret til at modtage Chlorambucil (median PFS 14,6 måneder mod henholdsvis 11,7 måneder). De samlede svarprocent var 83% og 55% (p <0.0001) og the complete response rates were 24% og 2% (p <0.0001) for Campath og chlorambucil arms respectively. The Kaplan-Meier curve for PFS is shown in Figure 1.
Figur 1: Progression Gratis overlevelse hos tidligere ubehandlede B-CLL-patienter*
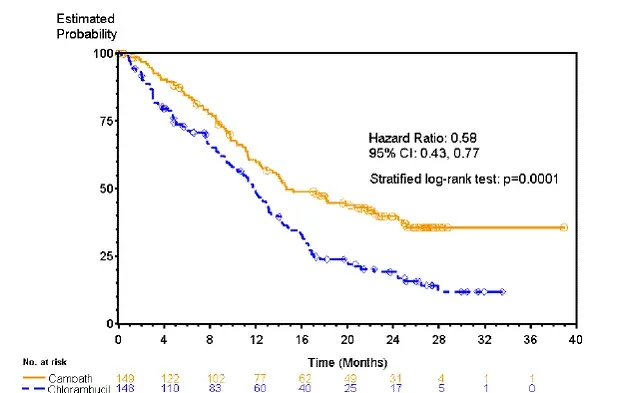 |
* Log-rank test justeret for RAI-fase (I-II vs. III-IV).
Tidligere behandlede B-CLL-patienter
Campath was evaluated in three multicenter open-label single-arm studies of 149 patients with B-CLL previously treated with alkylating agents fludarabine or other chemotherapies. Patients were treated with the recommended dose of Campath 30 mg intravenously 3 times per week for up to 12 weeks. Partial response rates of 21% to 31% og complete response rates of 0% to 2% were observed.
Patientinformation til Campath
Cytopenier
Rådgiv patienter om at rapportere eventuelle tegn eller symptomer, såsom blødning Easy Bruising Petechiae eller Purpura Pallor Svaghed eller træthed [Se ADVARSELS AND FORHOLDSREGLER og Bivirkninger ].
Infusionsrelaterede reaktioner
Rådgiv patienter om tegn og symptomer på infusionsrelaterede reaktioner og behovet for at tage premedikationer som foreskrevet [se ADVARSELS AND FORHOLDSREGLER og Bivirkninger ].
Immunsuppression/infektioner
Rådgive patienter om straks at rapportere symptomer på infektion (f.eks. Pyrexia) og at tage profylaktiske anti-infektive til PCP (trimethoprim/sulfamethoxazol DS eller tilsvarende) og for herpesvirus (famciclovir eller ækvivalent) som foreskrevet [se [se ADVARSELS AND FORHOLDSREGLER og Bivirkninger ].
Rådgive patienter om, at bestråling af blodprodukter er påkrævet [se ADVARSELS AND FORHOLDSREGLER ].
Immunisering
Rådgiv patienter om, at de ikke bør immuniseres med levende virale vacciner, hvis de for nylig er blevet behandlet med Campath. Rådgiv kvinder med spædbørn udsat for Campath i utero for at informere børnelæge om eksponeringen [se ADVARSELS AND FORHOLDSREGLER ].
Embryo-føtal toksicitet
Rådgive gravide kvinder og kvinder med reproduktivt potentiale for den potentielle risiko for et foster. Rådgive kvinder om at informere deres sundhedsudbyder om en kendt eller mistænkt graviditet [se Brug i specifikke populationer ].
Rådgiv kvindelige patienter om reproduktivt potentiale til at bruge effektiv prævention under behandling med Campath og i 3 måneder efter den endelige dosis [se Brug i specifikke populationer ].
Amning
Rådgiv kvinder om ikke at amme under behandling med Campath og i 3 måneder efter den endelige dosis [se Brug i specifikke populationer ].
Infertilitet
Rådgive kvinder og mænd med reproduktivt potentiale, som Campath kan forringe fertiliteten [se Brug i specifikke populationer og Ikke -klinisk toksikologi ].
Glomerulære nefropatier
Rådgiv patienter om skilte og symptomer på glomerulære nefropatier, der kan forekomme måneder til år efter at have modtaget Campath [se Bivirkninger ].