Tegnedi
Oplysningerne På Webstedet Er Ikke Medicinsk Rådgivning. Vi Sælger Ikke Noget. Nøjagtigheden Af Oversættelsen Er Ikke Garanteret. Ansvarsfraskrivelse
Resume af lægemiddeloversigt
Hvad er Tegsedi?
Tegsedi (inoteren) er en transthyretin-instrueret antisense oligonukleotid indikeret til behandling af polyneuropati ved arvelig transthyretin-medieret amyloidose hos voksne.
Hvad er bivirkninger af Tegsedi?
Tegnedi
- elveblest
- Besvær
- Hævelse af dine ansigtslæber tunge eller hals
- Pludselig følelsesløshed eller svaghed (især på den ene side af kroppen)
- sløret tale
- hængende øjenlåg
- Problemer med vision eller balance
- puffede øjne
- hævelse i dine hænder eller fødder
- åndenød
- opkast
- vægttab
- Rygsmerter
- muskelsvaghed
- Let blå mærker
- Usædvanlig blødning (næse tandkød eller et snit)
- lilla eller røde pletter under din hud
- Tung menstruationsblødning
- Alvorlig hovedpine
- Halsstivhed
- Blødning i de hvide i dine øjne
- Sort eller blodig afføring
- lyserød eller brun urin
- Hoste blod
- opkast, der ligner kaffegrunde
- Tab af appetit
- Mavesmerter (øverste mave højre side)
- guling af huden eller øjnene ( gulsot )
- Mørk urin
- brystsmerter
- influenza-lignende symptomer
- Varme eller kulderystelser
- Rødhed på håndfladerne
- muskler eller ledssmerter og
- Ukontrollerede muskelbevægelser
Få medicinsk hjælp med det samme, hvis du har nogen af de symptomer, der er anført ovenfor.
Almindelige bivirkninger af Tegsedi inkluderer injektionsstedets reaktioner iCluding:
skudt til strep hals hos voksne
- blå mærker
- rødme
- En hård klump
- betændelse
- hævelse
- smerte
- kløe
- udslæt
- elveblest
Bivirkninger kan også omfatte:
- kvalme
- hovedpine
- træthed
- blodplader med lavt blod (thrombocytopeni) og
- feber
Tegsedi kan forårsage alvorlige bivirkninger, herunder:
- Slag. Tegsedi kan forårsage en Slag . En person, der tog Tegsedi, havde et slagtilfælde, der opstod inden for 2 dage efter den første dosis. Signer eller symptomer på slagtilfælde kan omfatte:
- Pludselig følelsesløshed eller svaghed, især på den ene side af kroppen
- Alvorlig hovedpine or nakkesmerter
- forvirring
- Problemer med synstale eller balance
- Droopy øjenlåg
Få nødhjælp med det samme, hvis du har symptomer på slagtilfælde.
- Problemer med inflammatoriske og immunsystem. Nogle mennesker, der tog Tegsedi, havde alvorlige inflammatoriske og immunsystemproblemer. Symptomer på inflammatoriske og immunsystemproblemer omfattede uventet ændring i vandresvaghed og spasmer i benene på rygsmerter vægttab Hovedpine opkast og problemer med tale.
- levereffekter. Tegsedi kan forårsage leverproblemer. Din sundhedsudbyder skal lave laboratorieundersøgelser for at kontrollere din lever, inden du starter Tegsedi, og mens du bruger den. Fortæl din sundhedsudbyder, hvis du har symptomer på, at din lever muligvis ikke fungerer rigtigt, hvilket kan omfatte uventet kvalme og opkast mavesmerter, der ikke er sulten gulning af huden eller har mørk urin.
- Allergiske reaktioner. Tegsedi kan forårsage alvorlige allergiske reaktioner. Disse allergiske reaktioner forekommer ofte inden for 2 timer efter injektion af Tegsedi. Få nødhjælp med det samme, hvis du har symptomer på en allergisk reaktion, herunder:
- ledssmerter
- brystsmerter
- højt blodtryk
- kulderystelser
- Skylning
- Sværheds vanskeligheder
- rødme on palms of hogs
- rysten eller rykkende bevægelser
- Muskelsmerter
- influenza-lignende symptomer
- Øjenproblemer (lavt vitamin A -niveau). Behandling med Tegsedi vil sænke vitamin A -niveauerne i dit blod. Din sundhedsudbyder skal bede dig om at tage A -vitamin -tilskud, mens du bruger Tegsedi. Din sundhedsudbyder fortæller dig, hvor meget du skal tage. Ring til din sundhedsudbyder, hvis du får øjenproblemer, såsom at have svært ved at se om natten eller i områder med lavt oplyste områder ( Natblindhed ). Din sundhedsudbyder skal sende dig for at se en øjenlæge (øjenlæge).
Søg medicinsk behandling eller ring 911 på én gang, hvis du har følgende alvorlige bivirkninger:
- Alvorlige øjensymptomer såsom pludseligt synstab sløret synet tunnel vision øje smerter eller hævelse eller at se haloer omkring lys;
- Alvorlige hjertesymptomer såsom hurtig uregelmæssige eller bankende hjerteslag; flagrende i brystet; åndenød; og pludselig svimmelhed lethed eller udlevering;
- Alvorlig hovedpine forvirring sløret talearm eller ben svaghed problemer med at gå tab af koordination føles ustabil meget stive muskler høj feber voldsom sved eller rysten.
Dette dokument indeholder ikke alle mulige bivirkninger, og andre kan forekomme. Kontakt din læge for yderligere oplysninger om bivirkninger.
Dosering til Tegsedi
Den anbefalede dosering af Tegsedi er 284 mg administreret ved subkutan injektion en gang ugentligt.
Hvilke stoffer stoffer eller kosttilskud interagerer med Tegsedi?
Tegsedi kan interagere med:
- Antiplatelet medicin
- aspirin
- Ikke-steroide antiinflammatoriske lægemidler (NSAID'er)
- Antikoagulantia og
- Nefrotoksiske lægemidler og andre lægemidler, der kan forringe nyrefunktionen.
Fortæl din læge alle medicin og kosttilskud, du bruger.
Tegsedi under graviditet og amning
Fortæl din læge, hvis du er gravid eller planlægger at blive gravid, før du bruger Tegsedi. Tegsedi -behandling fører til et fald i serum -vitamin A -niveauer, og vitamin A -tilskud anbefales til, at patienter, der tager Tegsedi. Vitamin A -niveauer skal overvåges hos gravide kvinder, der tager Tegsedi. Det er ukendt, om Tegsedi passerer til modermælk. Kontakt din læge inden amning.
Yderligere oplysninger
Vores Tegsedi (Inotersen) injektion til subkutan brug bivirkninger Drug Center giver et omfattende overblik over tilgængelige lægemiddelinformation om de potentielle bivirkninger, når du tager denne medicin.
FDA -lægemiddelinformation
- Lægemiddelbeskrivelse
- Indikationer
- Bivirkninger
- Advarsler
- Overdosis
- Klinisk farmakologi
- Medicin vejledning
ADVARSEL
Thrombocytopeni og glomerulonephritis
Thrombocytopeni
Tegsedi forårsager reduktion i blodpladetælling, der kan resultere i pludselig og uforudsigelig thrombocytopeni, som kan være livstruende. En klinisk forsøgspatient døde af intrakraniel blødning.
Tegsedi er kontraindiceret hos patienter med et blodpladetælling under 100 x 109/L [se Kontraindikationer og advarsler og FORHOLDSREGLER ].
Før Tegsedi startede et blodpladetælling [se Dosering og administration ]. During treatment monitor platelet counts weekly if values are 75 x 109/L eller større og hyppigere, hvis værdier er mindre end 75 x 109/L [se Dosering og administration og advarsler og FORHOLDSREGLER ].
Hvis en patient udvikler tegn eller symptomer på thrombocytopeni opnår et blodpladetælling så hurtigt som muligt. Patienten bør ikke modtage yderligere Tegsedi, medmindre et blodpladetælling er bestemt til at være fortolkbar og acceptabel af en medicinsk professionel [se advarsler og FORHOLDSREGLER ].
Efter seponering af behandlingen af enhver grund fortsætter med at overvåge blodpladetælling i 8 uger eller længere, hvis blodpladetællinger er mindre end 100 x 109/L for at kontrollere, at blodpladetællinger forbliver over 75 x 109/L [se Dosering og administration ].
Glomerulonephritis
Tegsedi kan forårsage glomerulonephritis, der kan kræve immunsuppressiv behandling og kan resultere i dialyseafhængig nyresvigt. En klinisk forsøgspatient, der udviklede glomerulonephritis og ikke modtog immunsuppressiv behandling, forblev dialyseafhængig.
I kliniske forsøg blev tilfælde af glomerulonephritis ledsaget af nefritisk syndrom, som kan have manifestationer af ødemets hypercoagulabilitet med venøs eller arteriel trombose og øget modtagelighed for infektion [se advarsler og FORHOLDSREGLER ].
Tegsedi bør generelt ikke initieres hos patienter med urinprotein og kreatininforhold (UPCR) på 1000 mg/g eller højere [se Dosering og administration og advarsler og FORHOLDSREGLER ].
Før Tegsedi startede Tegsedi estimerede serumkreatininet glomerulær filtreringshastighed (EGFR) urinprotein og kreatininforhold (UPCR) og udfører en urinalyse [se Dosering og administration ]. During treatment monitor serum creatinine eGFR urinalysis og UPCR every every two weeks. Tegnedi should not be given to patients who develop a UPCR of 1000 mg/g or higher or eGFR below 45 mL/minute/1.73 m² i afventning af yderligere evaluering af årsagen.
Hvis der holdes en dosis, når EGFR øges til ≥45 ml/minut/1,73 m², falder UPCR til under 1000 mg/g, eller den underliggende årsag til fald i nyrefunktionen korrigeres ugentlig dosering kan geninitieres. Hos patienter med UPCR på 2000 mg/g eller højere udfører yderligere evaluering for akut glomerulonephritis som klinisk indikeret. Hvis akut glomerulonephritis bekræftes, at Tegsedi skal afbrydes permanent [se Dosering og administration og advarsler og FORHOLDSREGLER ].
Tegsedi REMS -program
På grund af risikoen for alvorlig blødning forårsaget af svær thrombocytopeni, og på grund af glomerulonephritis, som begge kræver hyppig overvågning af Tegsedi er kun tilgængelig gennem et begrænset distributionsprogram under en risikovurderings- og afbødningsstrategi (REMS) kaldet TEGSEDI REMS -programmet [se advarsler og FORHOLDSREGLER ].
Beskrivelse af Tegsedi
Inoteren er et antisense -oligonukleotid (ASO) -inhibitor af humant transthyretin (TTR) proteinsyntese.
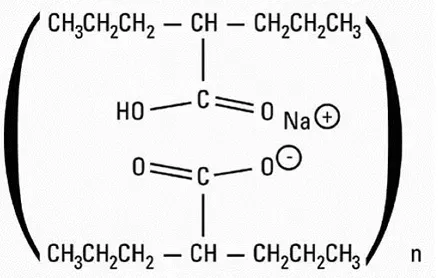
Tegsedi indeholder inoteren -natrium som den aktive ingrediens. Inoteren -natrium er et hvidt til lysegult fast stof, og det er frit opløseligt i vand og i phosphatbuffer (pH 7,5 til 8,5). Det kemiske navn på inotersen-natrium er DNA D (p-thio) ([2'-o- (2-methoxyethyl)] m5ru- [2'-o- (2- methoxyethyl)] m5rc- [2'-o- (2-methoxyethyl)] m5ru- [2'-o- (2-methoxyethyl)] m5ru-[2'-o- (2-o-O (2-O-o- (2-o- (2-methoxyyetyl)] m5ru-[2'-o- (2-o-O (2-O-O- (2-methoxyyyL)]] methoxyethyl)] rg-g-t-t-a-m5c-a-t-g-a-a- [2'-o- (2-methoxyethyl)] ra- [2'-o- (2-methoxyethyl)] m5ru- [2'-o- (2-methoxyethyl)] m5rc- [2'-o- (2-methoxyyl)] m5rc- [2-2'-O (2-O (2-O (2-O (2-O (2-O (2-O (2-methoxyyl)]]]] methoxyethyl)] m5rc). Den molekylære formel af inoteren -natrium er C230H299N69 Na19O121P19S19 og molekylvægten er 7600,73 da. Det har følgende strukturelle formel:
 |
Den molekylære formel for inoteren -fri base er C230H318N69O121P19S19 og dens molekylvægt er 7183.08.
Tegsedi er en steril konserveringsfri vandig opløsning til subkutan injektion. Det leveres i en forudfyldt sprøjte (PFS). Hver PFS indeholder 1,5 ml opløsning indeholdende 284 mg inoteren (svarende til 300 mg inoteren natriumsalt) Tegsedi er formuleret i vand til injektion og kan omfatte hydrochlorsyre og/eller natriumhydroxid til pH-justering til 7,5- 8,5.
Anvendelser til Tegsedi
Tegsedi er indikeret til behandling af polyneuropati af arvelig transthyretinmedieret amyloidose hos voksne.
Dosering til Tegsedi
Doseringsoplysninger
Den anbefalede dosis af Tegsedi er 284 mg injiceret subkutant en gang ugentligt.
For konsistens af doseringspatienter skal instrueres i at give injektionen samme dag hver uge.
Hvis en dosis er savnet, skal patienter instrueres i at tage den ubesvarede dosis så hurtigt som muligt, medmindre den næste planlagte dosis er inden for 2 dage. I denne situation skal patienten rettes til at springe den ubesvarede dosis over og tage den næste planlagte dosis på den planlagte dag.
Administration
- Tegsedi er kun beregnet til subkutan brug.
- Den første injektion, der administreres af patienten eller plejeren, skal udføres under vejledning af en passende kvalificeret sundhedspersonale. Patienter og/eller plejere skal trænes i den subkutane administration af Tegsedi i overensstemmelse med brugsinstruktionerne.
- Parenterale lægemiddelprodukter skal inspiceres visuelt for partikler og misfarvning inden administration, hver gang løsning og containertilladelse [se Hvor leveret ].
- Websteder til injektion inkluderer maven øvre lårregion eller det ydre område af overarmen. Det er vigtigt at rotere steder til injektion.
- Hvis injiceret i overarmen injektionen skal administreres af en anden person end patienten.
- Injektion bør undgås i taljen og andre steder, hvor der kan forekomme tryk eller gnidning fra tøj.
- Tegsedi bør ikke injiceres i områder med hudsygdom eller skade.
- Tatoveringer og ar bør også undgås.
- Tegsedi -præfyldt sprøjte skal have lov til at nå stuetemperatur inden injektion.
- Fjern det fra kølet opbevaring mindst 30 minutter før brug.
- Andre opvarmningsmetoder bør ikke anvendes.
- Brug hver forfyldt sprøjte kun én gang.
Vurdering inden indledningen af Tegsedi
Mål blodpladetæller serum creatinin estimeret glomerulær filtreringshastighed (EGFR) urinprotein og kreatininforhold (UPCR) alaninaminotransferase (ALT) aspartataminotransferase (AST) og total bilirubin og udfører urinalyse Laboratorietest og overvågning for at vurdere sikkerheden efter påbegyndelse af Tegsedi og ADVARSELS AND FORHOLDSREGLER ].
Laboratorietest og overvågning for at vurdere sikkerheden efter påbegyndelse af Tegsedi
Monitor blodpladetæller serumkreatinin estimeret glomerulær filtreringshastighed (EGFR) urinalyse urinprotein og kreatininforhold (UPCR) alaninaminotransferase (ALT) aspartataminotransferase (AST) og total bilirubin under behandling med Tegsedi og i 8 uger efter seponering af behandlingen.
Blodpladetælling
Initier ikke Tegsedi hos patienter med et blodpladetælling mindre end 100 x 109/L. Overvåg blodpladetælling under hele behandlingsforløbet med Tegsedi og i 8 uger efter seponering af behandlingen. Anbefalinger til blodpladeovervågningsfrekvens og Tegsedi -dosering er specificeret i tabel 1. Hvis en patient udvikler tegn eller symptomer på thrombocytopeni, opnår et blodpladetælling så hurtigt som muligt og holder dosering, indtil blodpladetællingen er bekræftet. Kontroller blodpladetællingen så hurtigt som muligt, hvis en blodplademåling er ufortolkelig (f.eks. Klumpet prøve) [se ADVARSELS AND FORHOLDSREGLER ].
Tabel 1: Tegsedi Monitoring and Treatment Anbefalinger til blodpladetælling
| Blodpladetælling (x109/L) | Overvågningsfrekvens | Dosering |
| Mindst 100 | Ugentlig | Fortsæt med at dosere ugentligt. |
| Mindst 75 til mindre end 100 | Ugentlig | Stop behandling. Genstart ikke, medmindre blodpladetællingen er større end 100. |
| Mindst 50 til mindre end 75 | To gange ugentligt indtil 3 på hinanden følgende værdier over 75; derefter ugentlig overvågning. | Stop behandling. Genstart ikke Tegsedi hos patienter med thrombocytopeni, medmindre der har været 3 på hinanden følgende værdier over 100, og fordelen ved Tegsedi opvejer risikoen for thrombocytopeni og potentiel blødning. |
| Mindst 25 til mindre end 50* | To gange ugentligt indtil 3 på hinanden følgende værdier over 75; derefter ugentlig overvågning. Consider more frequent monitoring if additional risk factors for bleeding are present.# | Stop behandling. Genstart ikke Tegsedi hos patienter med thrombocytopeni, medmindre der har været 3 på hinanden følgende værdier over 100, og fordelen ved Tegsedi opvejer risikoen for thrombocytopeni og potentiel blødning. Kortikosteroider anbefales. Overvej seponering af alle antiplateletmidler eller antikoagulantia. |
| Mindre end 25*† | Dagligt indtil 2 på hinanden følgende værdier over 25. Overvåg derefter to gange ugentligt indtil 3 på hinanden følgende værdier over 75. derefter ugentlig overvågning, indtil den er stabil. | Stop Tegsedi. Kortikosteroider anbefales. Overvej seponering af alle antiplateletmidler eller antikoagulantia. |
| * Det anbefales stærkt, at medmindre patienten har en medicinsk kontraindikation til at modtage glukokortikoider, modtager patienten glukokortikoidbehandling for at vende blodpladesnedgangen [se ADVARSELS AND FORHOLDSREGLER ]. †Patienter, der afbryder terapi med Tegsedi på grund af blodpladetællinger under 25 x109/L bør ikke geninitiere terapi. |
Nyreovervågning
Tegsedi bør generelt ikke initieres hos patienter med et urinprotein og kreatininforhold (UPCR) på 1000 mg/g eller højere. Overvåg serumkreatinin estimeret glomerulær filtreringshastighed (EGFR) urinalyse og UPCR hver 2. uge under behandling med Tegsedi. Hold Tegsedi hos patienter, der udvikler en UPCR på 1000 mg/g eller højere eller estimeret glomerulær filtreringshastighed (EGFR) under 45 ml/minut/1,73 m2 i afventning af yderligere evaluering af årsagen.
Hvis en dosis holdes, når EGFR øges til ≥45 ml/minut/1,73 m2 UPCR falder til under 1000 mg/g, eller den underliggende årsag til faldet i nyrefunktion korrigeres ugentlig dosering kan genindstilles. I tilfælde af UPCR på 2000 mg/g eller højere udfører yderligere evaluering for akut glomerulonephritis som klinisk indikeret. Hvis akut glomerulonephritis bekræftes, skal Tegsedi afbrydes permanent.
Leverprøver
Overvåg alaninaminotransferase (ALT) aspartataminotransferase (AST) og total bilirubin månedligt under behandling med Tegsedi [se ADVARSELS AND FORHOLDSREGLER ]. Tegnedi should be discontinued in patients suspected of developing liver injury induced by Tegnedi [see ADVARSELS AND FORHOLDSREGLER ].
Hvor leveret
Doseringsformularer og styrker
Indsprøjtning : 284 mg/1,5 ml klar farveløs til lysegul opløsning i en enkeltdosis forfyldt sprøjte.
Opbevaring og håndtering
Tegnedi er en klar farveløs at lysegul opløsning leveret i en enkeltdosis-præfyldt sprøjte med en SSD. Hver præfyldt sprøjte af Tegsedi er fyldt til at levere 1,5 ml opløsning indeholdende 284 mg inoteren (svarende til 300 mg inotersen natriumsalt).
Tegnedi fås i kartoner, der indeholder 1 eller 4 forudfyldte sprøjter, der leveres i individuelle bakker.
- Pakke med 1 forudfyldt sprøjte: NDC 72126-007-03
- Pakke med 4 forudfyldte sprøjter: NDC 72126-007-01
Den individuelle bakke med 1 sprøjte er NDC 72126-007-02.
Apotek
Opbevar kølet ved 2 ° C til 8 ° C (36 ° F til 46 ° F) i den originale beholder og beskyt mod direkte lys. Frys ikke.
For patienter/plejere
Opbevar kølet ved 2 ° C til 8 ° C (36 ° F til 46 ° F) i den originale beholder. Frys ikke.
Tegnedi can be kept at room temperature (up to 30°C [86°F]) in the original container for up to 6 weeks; if not used within the 6 weeks discard Tegnedi.
Fjern fra kølet opbevaring (2 ° C til 8 ° C [36 ° F til 46 ° F]) mindst 30 minutter før brug. [Tegsedi] Forparet sprøjte skal have lov til at nå stuetemperatur inden injektion.
Undgå eksponering for temperaturer over 30 ° C (86 ° F).
Distribueret af Sobi Inc Waltham Ma. Revideret: Jan 2024
Bivirkninger til Tegsedi
Følgende alvorlige bivirkninger diskuteres mere detaljeret i andre sektioner af mærkningen:
- Thrombocytopeni [see ADVARSELS AND FORHOLDSREGLER ]
- Glomerulonephritis og Renal Toxicity [see ADVARSELS AND FORHOLDSREGLER ]
- Slag og cervicocephalic arteriel dissektion [se ADVARSELS AND FORHOLDSREGLER ]
- Inflammatoriske og immuneffekter [se ADVARSELS AND FORHOLDSREGLER ]
- Leverskade [se ADVARSELS AND FORHOLDSREGLER ]
- Overfølsomhed [se ADVARSELS AND FORHOLDSREGLER ]
- Nedsat serum vitamin A -niveauer og anbefalet tilskud [se ADVARSELS AND FORHOLDSREGLER ]
Kliniske forsøg oplever
Fordi kliniske forsøg udføres under vidt forskellige tilstande, kan der ikke sammenlignes bivirkninger, der er observeret i de kliniske forsøg med Tegsedi, ikke direkte med hastigheder i kliniske forsøg med andre lægemidler og muligvis ikke afspejler de satser, der er observeret i praksis.
I alt 112 voksne patienter med polyneuropati forårsaget af arvelig transthyretin-medieret amyloidose (HATTR) modtog TEGSEDI i undersøgelse 1 og 60 patienter modtog placebo. Undersøgelsespatienterne var 59 år (27 til 78 år). Af de TEGSEDI-behandlede patienter var 69% mandlige og 94% var kaukasiske med en gennemsnitlig eksponering på 385 dage og medianeksponering på 449 dage. Baseline-sygdomsegenskaber var stort set ens hos TEGSEDI-behandlede patienter og patienter i placebo-kontrolgruppen. Syvogtres procent af patienterne var i fase 1 af sygdommen ved baseline og 33% i fase 2. toogtredive procent af patienterne havde Val30met-mutationer i TTR-genet med de resterende 48% bestående af 26 forskellige andre punktmutationer.
Tabel 2 viser almindelige bivirkninger, der forekom hos mindst 5% af TEGSEDI-behandlede patienter, og som forekom mindst 5% hyppigere eller to gange hyppigere end på placebo.
diflucan 100 mg i 5 dage
De mest almindelige bivirkninger, der opstod hos mindst 20% af Tegsedi-behandlede patienter og hyppigere end på placebo, var injektionsstedets reaktioner kvalme hovedpine træthedstrombocytopeni og feber. Alvorlige bivirkninger var hyppigere hos TEGSEDI-behandlede patienter (32%) end hos patienter på placebo (21%). De mest almindelige bivirkninger, der førte til seponering, var thrombocytopeni og cachexia.
Tabel 2: Bivirkninger rapporteret hos mindst 5% TEGSEDI-behandlede patienter, og som forekom mindst 5% hyppigere eller mindst to gange hyppigere end placebo-patienter (undersøgelse 1)
| Tegnedi (N = 112) % | Placebo (N = 60) % | |
| Indsprøjtning site reactionsa | 49 | 10 |
| Nausea | 31 | 12 |
| Hovedpine | 26 | 12 |
| Træthed | 25 | 20 |
| Thrombocytopeni | 24 | 2 |
| Feber | 20 | 8 |
| Perifert ødem | 19 | 10 |
| Kulderystelser | 18 | 3 |
| Anæmi | 17 | 3 |
| Opkast | 15 | 5 |
| Myalgi | 15 | 10 |
| Nedsat nyrefunktion | 14 | 5 |
| Arytmib | 13 | 5 |
| Arthralgia | 13 | 8 |
| Pre-synkope eller synkope | 13 | 5 |
| Nedsat appetit | 10 | 0 |
| Paræstesi | 10 | 3 |
| Dyspnø | 9 | 3 |
| Forhøjet leverfunktionstest | 9 | 3 |
| Orthostase | 8 | 2 |
| Influenza-lignende sygdom | 8 | 3 |
| Kontusion | 7 | 2 |
| Bakteriel infektionc | 7 | 3 |
| Eosinophilia | 5 | 0 |
| Tør mund | 5 | 2 |
| a Inkluderer blå mærker erythema hæmatomblødning Indurationsinflammationsmasse ødemer smerter klidus udslæt hævelse og urticaria. b Inkluderer arytmi atrieflimmer atrieflutter Bradyarythmia Bradycardia Extrasystoles Sinus Arrythmia Sinus Bradycardia Supraventrikulære ekstrasystoler Tachycardia og ventrikulære ekstrasystoler. c Inkluderer bakteræmi cellulitis Staphylococcal clostridium difficile infektion konjunktivitis bakteriel cystitis Escherichia helicobacter gastritis helicobacter infektion stafylokokkinfektion. |
Immunogenicitet
Påvisningen af antistofdannelse er meget afhængig af følsomheden og specificiteten af assayet. Derudover kan den observerede forekomst af antistof (inklusive neutraliserende antistof) positivitet i et assay påvirkes af adskillige faktorer, herunder assaytetodikprøvens håndtering af timing af prøveopsamling samtidig medicin og underliggende sygdom. Af disse grunde sammenligning af forekomsten af antistoffer med Tegsedi i de undersøgelser beskrevet nedenfor med forekomsten af antistoffer i andre undersøgelser eller til andre produkter kan være vildledende.
I undersøgelse 1 30% af TEGSEDI-behandlede patienter testede positivt for anti-narkotika antistoffer (ADA) efter 65 ugers behandling [se ADVARSELS AND FORHOLDSREGLER ]. However the assay measured only IgG isotypes og the existence of other isotypes may be possible. In many cases adverse reactions occurred in patients with ADA although the available data are too limited to make definitive conclusions about the relationship.
Lægemiddelinteraktioner for Tegsedi
Antiplatelet -lægemidler eller antikoagulerende medicin
På grund af risikoen for thrombocytopeni skal der anvendes forsigtighed, når man bruger antiplatelet-lægemidler (f.eks. Adenosin clopidogrel prasugrel ticagrelor eller ticlopidin) inklusive ikke-receptpligtige produkter, der påvirker blodplader (f.eks. Aspirin ikke-steroidal anti-inflammatoriske lægemidler) eller antikoagulanter (f.eks. Hanparin-krig Tegsedi [se ADVARSELS AND FORHOLDSREGLER ].
Nefrotoksiske lægemidler
På grund af risikoen for glomerulonephritis og nyretoksicitet skal forsigtighed anvendes, når man bruger nefrotoksiske lægemidler og andre lægemidler, der kan forringe nyrefunktionen samtidig med Tegsedi [se ADVARSELS AND FORHOLDSREGLER ].
Advarsler for Tegsedi
Inkluderet som en del af 'FORHOLDSREGLER' Afsnit
Forholdsregler for Tegsedi
Thrombocytopeni
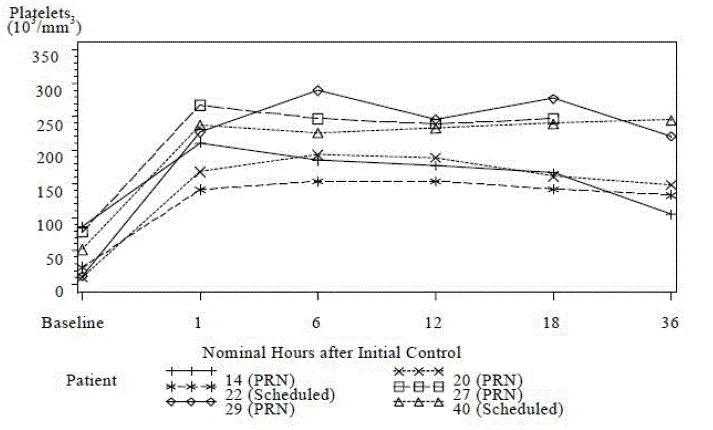
Tegnedi causes reductions in platelet count at any time during treatment that may result in sudden og unpredictable thrombocytopenia that can be life-threatening. I undersøgelse 1 [se Kliniske studier ] blodplade tæller under 100 x 109/L forekom hos 25% af Tegsedi-behandlede patienter sammenlignet med 2% af patienterne på placebo. Blodplade tæller under 75 x 109/L forekom hos 14% af Tegsedi-behandlede patienter sammenlignet med ingen patient på placebo. I undersøgelse 1 og dens udvidelsesundersøgelse 39% af Tegsedi-behandlede patienter med en baseline blodpladetal under 200 x109/L havde en nadir blodpladetælling under 75 x 109/L sammenlignet med 6% af patienterne med baseline blodpladetællinger 200 x109/L eller højere.
Tre tegsedi-behandlede patienter (3%) havde pludselig alvorlig thrombocytopeni (blodpladetælling under 25 x 109/L) which can have potentially fatal bleeding complications including spontaneous intracranial or intrapulmonary hemorrhage. One patient in a clinical trial experienced a fatal intracranial hemorrhage.
I kliniske forsøg havde alle 3 patienter med alvorlig thrombocytopeni behandling-opstående antiplatelet-IgG-antistoffer kort før eller på tidspunktet for den alvorlige trombocytopeni. Hos 2 patienter forårsagede blodpladeklumping ufortolkede blodplade -målinger, der forsinkede diagnosen og behandlingen af svær thrombocytopeni. Blodpladeklumping kan være forårsaget af en reaktion mellem antiplateletantistoffer og ethylendiaminetetraeddikesyre (EDTA) [se Ufortolkede blodpladetællinger: Reaktion mellem antiplateletantistoffer og ethylendiaminetetra-eddikesyre (EDTA) ].
Overvågning og dosering
Patienter, der ikke er i stand til at overholde den anbefalede laboratorieovervågning eller til de relaterede behandlingsanbefalinger, må ikke modtage Tegsedi. Initier ikke Tegsedi hos patienter med et blodpladetælling under 100 x 109/L. Følg anbefalede overvågnings- og behandlingsanbefalinger til blodpladetælling [se Dosering og administration ]. If a patient develops signs or symptoms of thrombocytopenia obtain a platelet count as soon as possible og hold Tegnedi dosing unless the platelet count is confirmed to be acceptable. Recheck the platelet count as soon as possible if a platelet measurement is uninterpretable (e.g. clumped sample) [Se Ufortolkede blodpladetællinger: Reaktion mellem antiplateletantistoffer og ethylendiaminetetra-eddikesyre (EDTA) ]. Hold Tegnedi dosing until an acceptable platelet count is confirmed with an interpretable blood sample.
Samtidig medicin med blodpladeffekter
Når man overvejer brugen af Tegsedi samtidigt med antiplatelet -lægemidler eller antikoagulantia, skal9/L [se Lægemiddelinteraktioner ].
Symptomer på thrombocytopeni
Symptomer på thrombocytopeni kan omfatte usædvanlige eller langvarige blødning (f.eks. Petechiae Easy Bruising Hematoma Subconjunctival blødning af tandkødsblødning epistaxis hæmoptyse uregelmæssig eller tungere end normal menstruationsblødning af hæmatemese Hematuria Hematochezia Melena) Halsstivhed eller atypisk alvorlig hovedme. Patienter og plejere bør instrueres om at være årvågen for symptomer på thrombocytopeni og søge øjeblikkelig medicinsk hjælp, hvis de er bekymrede.
Alvorlig thrombocytopeni
Behandling med glukokortikoider
Glucocorticoid -terapi anbefales stærkt hos patienter med et blodpladetælling under 50 x 109/L og hos patienter med mistænkt immunmedieret thrombocytopeni. Undgå at bruge Tegsedi hos patienter, for hvilke glukokortikoidbehandling ikke anbefales.
Glomerulonephritis And Renal Toxicity
Tegnedi can cause glomerulonephritis that may result in dialysis-dependent renal failure. I undersøgelse 1 [se Kliniske studier ] Glomerulonephritis forekom hos tre (3%) TEGSEDI-behandlede patienter mod ingen patient på placebo. Hos disse patienter var stop af Tegsedi alene ikke tilstrækkelig til at løse manifestationer af glomerulonephritis og behandling med en immunsuppressiv medicin var nødvendig. En patient modtog ikke immunsuppressiv behandling og forblev dialyseafhængig. Hvis glomerulonephritis er mistænkt for at forfølge hurtig diagnose og initierer immunsuppressiv behandling så hurtigt som muligt.
Tilfælde af glomerulonephritis blev ledsaget af nefrotisk syndrom. Mulige komplikationer af nefrotisk syndrom kan omfatte ødemhypercoagulabilitet med venøs eller arteriel trombose og øget følsomhed for infektion. Tegsedi-behandlede patienter, der udvikler glomerulonephritis, kræver overvågning og behandling af nefrotisk syndrom og dets manifestationer.
Akkumulering af antisense -oligonukleotider i proksimale tubulusceller i nyrerne, der undertiden fører til øget rørformet proteinuri, er blevet beskrevet i ikke -kliniske studier. Urinprotein og kreatininforhold (UPCR) større end 5 gange den øvre normal grænse forekom hos 15% af TEGSEDI-behandlede patienter sammenlignet med 8% af patienterne på placebo. Forøgelse fra baseline hos serumkreatinin større end 0,5 mg/dL forekom hos 11% af TEGSEDI-behandlede patienter sammenlignet med 2% af patienterne på placebo.
Følg anbefalede overvågnings- og behandlingsanbefalinger til nyreparametre [se Dosering og administration ]. Tegnedi should generally not be initiated in patients with a UPCR of 1000 mg/g or greater. If acute glomerulonephritis is confirmed Tegnedi should be permanently discontinued [see Kontraindikationer ].
Vær forsigtig med nefrotoksiske lægemidler og andre lægemidler, der kan forringe nyrefunktionen. Fordi immunsuppressiv behandling er nødvendig til behandling af glomerulonephritis undgår at anvende Tegsedi hos patienter, for hvilke immunsuppressiv behandling ikke anbefales.
Tegsedi REMS -program
Tegnedi is available only through a restricted program under a Risk Evaluation og Mitigation Strategy (REMS) called the Tegsedi REMS -program because of risks of serious bleeding caused by severe thrombocytopenia og because of glomerulonephritis [see Thrombocytopeni Glomerulonephritis And Renal Toxicity ].
Vigtige krav til Tegsedi -ordineringsprogrammet inkluderer:
- Rekressører skal certificeres inden for programmet ved at tilmelde og gennemføre træning.
- Patienter skal tilmelde sig programmet og overholde løbende overvågningskrav [se Thrombocytopeni og Dosering og administration ]. Pharmacies must be certified with the program og must only dispense to patients who are authorized to receive Tegnedi.
Yderligere information inklusive en liste over kvalificerede apoteker/distributører er tilgængelige på www.tegsedirems.com eller 1-844-483-4736.
Slag og cervicocephalisk arteriel dissektion
Tegnedi may cause Slag og cervicocephalic arterial dissection. In clinical studies 1 of 161 (0.6%) Tegnedi-treated patients experienced carotid artery dissection og Slag. These events occurred within 2 days of the first Tegnedi dose a time when the patient also had symptoms of cytokine release (e.g. kvalme opkast muscular smerte og weakness) og a high sensitivity C-reactive protein level greater than 100 mg/L.
Uddann patienter om symptomerne på slagtilfælde og arteriel dissektion af centralnervesystemet. Instruer patienter om at søge hjælp så hurtigt som muligt, hvis der opstår symptomer på slagtilfælde eller arteriel dissektion.
Inflammatoriske og immuneffekter
Inflammatoriske og immunforandringer er en virkning af nogle antisense -oligonukleotidlægemidler inklusive Tegsedi. I kliniske studier forekom alvorlige inflammatoriske og immunbemærkningsreaktioner hos TEGSEDI-behandlede patienter, herunder immuntrombocytopeni og glomerulonephritis samt et enkelt tilfælde af antineutrofil cytoplasmisk autoantistof (ANCA) positiv systemisk vasculitis [se Glomerulonephritis And Renal Toxicity og Tegsedi REMS -program ].
Neurologiske alvorlige bivirkninger
I kliniske studier forekom neurologiske alvorlige bivirkninger, der var i overensstemmelse med inflammatoriske og immuneffekter, hos tegsedi-behandlede patienter ud over slagtilfælde og carotisarterie dissektion [se Inflammatoriske og immuneffekter ]. Two months after the first Tegnedi dose one patient developed a change in gait that progressed over 6 months to paraparesis in the absence of radiologic evidence of spinal cord compression. Another patient developed progressive lumbar smerte vægttab hovedpine opkast og impaired speech 7 months after starting Tegnedi. Cerebrospinal fluid analysis findings included elevated protein a lymphocyte-predominant pleocytosis og testing that was negative for infection. The patient recovered after empiric therapy (high-dose steroids antibiotics) og resumed Tegnedi without recurrence of symptoms.
Leverskade
Leveren er et sted for ophobning af antisense -oligonukleotider. I kliniske studier havde 8% af TEGSEDI-behandlede patienter en øget alaninaminotransferase (ALT) mindst 3 gange den øvre grænse for normal (ULN) sammenlignet med 3% af patienterne på placebo; 3% af Tegsedi-behandlede patienter havde en alt mindst 8 gange ULN sammenlignet med ingen patient på placebo. En klinisk undersøgelsespatient oplevede en øget alt mere end 30 gange ULN. Efter et kursus med kortikosteroider og seponering af Tegsedi vendte patientens ALT tilbage til normale niveauer. Nogle patienter havde opløsning af leverlaboratorieafvik med fortsat brug af Tegsedi.
I kliniske studier demonstrerede eller mulige tilfælde af immunmedieret galdesygdom forekom hos TEGSEDI-behandlede patienter. Der var et enkelt tilfælde af autoimmun hepatitis med primær galdecirrhose hos en patient med en familiehistorie med primær galdecirrhose samt et enkelt tilfælde af galdeobstruktion af uklar etiologi.
Overvåg alaninaminotransferase (ALT) aspartataminotransferase (AST) og total bilirubin ved baseline og månedligt under behandling med Tegsedi. Hvis en patient udvikler kliniske tegn eller symptomer, der tyder på leverdysfunktion (f.eks. Uforklaret kvalme opkastning af abdominal smerte, træthed anoreksi eller gulsot og/eller mørk urin), måler straks serumtransaminaser og total bilirubin og afbrydelsesbehandling med tegsedi.
Hvis en patient mistænkes for at have udviklet leverskade induceret af Tegsedi -behandling, skal TEGSEDI afbrydes.
Levertransplantationsafvisning
I en klinisk undersøgelsessager med afvisning af levertransplantation blev der rapporteret om 2-4 måneder efter start af Tegsedi hos patienter, hvis lever-allografts tidligere havde været klinisk stabile (i over 10 år), før Tegsedi startede. I disse tilfælde forbedrede patienterne klinisk og transaminase -niveauer normaliseret efter glukokortikoidadministration og ophør af Tegsedi.
Hos patienter med en historie med levertransplantationsmonitor alt AST og total bilirubin månedligt. Afbryd Tegsedi hos patienter, der udvikler tegn på afvisning af levertransplantation.
Overfølsomhedsreaktioner/antistofdannelse
Tegnedi can cause hypersensitivity reactions. In clinical studies 6 of 161 (4%) Tegnedi-treated patients stopped treatment because of a hypersensitivity reaction. Antibodies to Tegnedi were present when the reactions occurred. These reactions generally occurred within 2 hours of administration of Tegnedi og included hovedpine brystsmerter hypertension kulderystelser Skylning dysphagia palmar erythema eosinophilia involuntary choreaform movements arthralgia myalgia og influenza-lignende symptomer.
Tegn og symptomer på phenobarbital overdosis
Hvis der forekommer en overfølsomhedsreaktion, ophører administrationen af Tegsedi og initierer passende terapi. Brug ikke hos patienter, der har en historie med overfølsomhedsreaktion på Tegsedi.
Ufortolkede blodpladetællinger
Reaktion mellem antiplatelet-antistoffer og ethylendiaminetetra-eddikesyre (EDTA)
I undersøgelse 1 [se Kliniske studier ] 23% af TEGSEDI-behandlede patienter havde mindst 1 ufortolkede blodpladetælling forårsaget af blodpladeklumpning sammenlignet med 13% af patienterne på placebo. I 2 tilfælde af svær thrombocytopeni med blodpladetælling under 25 x 109/L hvoraf den ene resulterede i, at dødsklumpede blodpladeprøver forårsagede en forsinkelse i diagnose og behandling. Begge forsøgspersoner havde testet positivt for behandling af behandlingsvækst-anti-platelet-IgG-antistoffer, der blev påvist kort før eller på tidspunktet for den alvorlige reduktion i blodpladetællingen.
Selvom clumping med blodplade kan have en række årsager (f.eks. Ufuldstændigt blandet eller utilstrækkeligt antikoagulerede prøver) kan blodplade-klumpning være forårsaget af en reaktion mellem antiplatelet-antistoffer og ethylendiaminetetra-eddikesyre (EDTA). I undersøgelse 1 7 af de 9 (78%) TEGSEDI-behandlede patienter med behandling af behandlingsvækst-positive antiplatelet-antistof havde mindst 1 klumpet blodpladeprøve.
Hvis der er mistanke om EDTA-medieret blodpladeklumping, skal du udføre en gentagen blodpladetælling ved hjælp af et andet antikoagulant (f.eks. Natriumcitratheparin) i blodopsamlingsrøret. Kontroller blodpladetællingen så hurtigt som muligt, hvis en blodplademåling er ufortolkelig. Hold Tegsedi -dosering, indtil et acceptabelt blodpladetælling er bekræftet med en tolkbar blodprøve.
Nedsat serum vitamin A -niveauer og anbefalet tilskud
Tegnedi treatment leads to a decrease in serum vitamin A levels. Supplementation at the recommended daily allowance of vitamin A is advised for patients taking Tegnedi. Higher doses than the recommended daily allowance of vitamin A should not be given to try to achieve normal serum vitamin A levels during treatment with Tegnedi as serum vitamin A levels do not reflect the total vitamin A in the body.
Patienter skal henvises til en øjenlæge, hvis de udvikler okulære symptomer, der tyder på vitamin A -mangel (f.eks. Natblindhed).
Oplysninger om patientrådgivning
Rådgive patienten og plejeren om at læse den FDA-godkendte patientmærkning ( Medicin vejledning og Instructions for Use ).
Thrombocytopeni
Informer patienter om, at Tegsedi til enhver tid kan forårsage reduktioner i blodpladetællingen under behandlingen, der kan resultere i trombocytopeni. Instruer patienter om at underrette en sundhedsudbyder med det samme, hvis de viser symptomer på thrombocytopeni (f.eks. Usædvanlige eller langvarige blødningshalsstivhed eller atypisk svær hovedpine). Rådgive patienter om vigtigheden af overvågning under behandling med Tegsedi [se ADVARSELS AND FORHOLDSREGLER ]. Also instruct patients to notify their healthcare provider of all medications including over-the-counter that they are taking [see Lægemiddelinteraktioner ].
Glomerulonephritis And Renal Toxicity
Informer patienter om, at glomerulonephritis har forekommet hos patienter behandlet med Tegsedi. Rådgive patienter om vigtigheden af overvågning af urinprotein og kreatininforhold (UPCR under behandling med Tegsedi) [se ADVARSELS AND FORHOLDSREGLER ].
Tegsedi REMS -program
Tegnedi is available only through a restricted program called the Tegsedi REMS -program [see ADVARSELS AND FORHOLDSREGLER ]. Inform the patient of the following notable requirements:
- Patienter skal tilmelde sig programmet og overholde løbende overvågningskrav.
- Tegnedi is available only from certified pharmacies participating in the program. Therefore provide patients with the telephone number og website for information on how to obtain the product.
Slag og cervicocephalisk arteriel dissektion
Uddann patienten om symptomer på slagtilfælde og arteriel dissektion af centralnervesystemet og instruerer dem til at søge hjælp så hurtigt som muligt, hvis symptomer på disse eller andre alvorlige neurologiske bivirkninger forekommer [se ADVARSELS AND FORHOLDSREGLER ].
Leverskade
Instruer patienter om at informere en sundhedspersonale om symptomer, der antyder leverdysfunktion, der forekommer efter administration af Tegsedi [se ADVARSELS AND FORHOLDSREGLER ]. Advise patients of the importance of monitoring during treatment with Tegnedi.
Overfølsomhed
Instruer patienter om at informere en sundhedspersonale om symptomer, der tyder på overfølsomhed, der forekommer efter administration af Tegsedi [se ADVARSELS AND FORHOLDSREGLER ].
Anbefalet vitamin A -tilskud
Informer patienter om, at Tegsedi -behandling fører til et fald i vitamin A -niveauer målt i serumet. Instruer patienter om at tage den anbefalede daglige godtgørelse af vitamin A. Rådgive patienter om at kontakte deres sundhedsudbyder, hvis de oplever okulære symptomer, der tyder på vitamin A -mangel (f.eks. Natblindhed) og henvis dem til en øjenlæge, hvis de udvikler disse symptomer [se ADVARSELS AND FORHOLDSREGLER ].
Administration Instructions
Tog patienter og plejere på korrekt subkutan administrationsteknik, og hvordan man bruger den enkeltdosis forfyldte sprøjte. Instruer patienter og/eller plejere til at læse og følge instruktionerne til brug, hver gang de bruger Tegsedi.
Graviditet
Instruer patienter om, at hvis de er gravide eller planlægger at blive gravide, mens de tager Tegsedi, skal de informere deres sundhedsudbyder. Rådgiv kvindelige patienter om fødedygtige potentiale for den potentielle risiko for fosteret. Opmuntr patienter til at tilmelde sig Tegsedi graviditetsregistret, hvis de bliver gravide, mens de tager Tegsedi [se Brug i specifikke populationer ].
Ikke -klinisk toksikologi
Karcinogenese mutagenese nedskrivning af fertilitet
Carcinogenese
I en 26-ugers carcinogenicitetsundersøgelse i transgene (TGRASH2) mus ugentligt subkutan administration af inoteren (0 10 30 eller 80 mg/kg) eller en gnaverspecifik (farmakologisk aktiv) surrogat (30 mg/kg) resulterede ikke i en stigning i tumorer.
I en 94-ugers carcinogenicitetsundersøgelse hos rotter resulterede ugentligt subkutan administration af inoteren (0 0,5 2 eller 6 mg/kg) i en stigning i tumorer ved eller i nærheden af injektionsstedet hos mænd overhovedet, men den laveste dosis (0,5 mg/kg) testet. Subkutan malign pleomorf fibrosarkom blev forøget i midten og høje doser, og kombineret subkutan malign pleomorf fibrosarkom og monomorfe fibrosarkom blev forøget i den høje dosis. Disse tumorer betragtes som et respons på kronisk vævsirritation og betændelse forårsaget af gentagen subkutan injektion.
Mutagenese
Inoteren var negativ for genotoksicitet i In vitro (Bakteriel mutagenicitetskromosomal afvigelse i kinesisk hamster lunge) og forgæves (Mus knoglemarv mikronukleus) Assays.
Desoxymetason creme USP 0,25 til eksem
Værdiforringelse af fertiliteten
Subkutan administration af Inoteren (0 3 15 eller 25 mg/kg) eller en gnaverspecifik surrogat (15 mg/kg) til han- og hunmus hver anden dag før og under parring og fortsat i kvinder i hele organogenesen gav ingen bivirkninger på fertiliteten.
Brug i specifikke populationer
Graviditet
Graviditet Exposure Registry
Der er et graviditetseksponeringsregister, der overvåger graviditetsresultater hos kvinder, der udsættes for Tegsedi under graviditet. Udbydere af sundhedsvæsenet opfordres til at registrere patienter, og gravide kvinder opfordres til at registrere sig ved at ringe: 1-877-465-7510 E-mailing: [E -mail eller besøger online på: www.tegsedipregnancystudy.com.
Risikooversigt
Der er ingen data om udviklingsrisikoen forbundet med brugen af Tegsedi hos gravide kvinder. Tegsedi -behandling fører til et fald i serum -vitamin A -niveauer, og vitamin A -tilskud anbefales til, at patienter, der tager Tegsedi. A -vitamin er afgørende for normal embryofetaludvikling; Imidlertid er overdreven niveauer af vitamin A forbundet med ugunstige udviklingseffekter. Virkningerne på fosteret af en reduktion i moderlig serum TTR forårsaget af Tegsedi og af vitamin A -tilskud er ukendt [se Klinisk farmakologi ADVARSELS AND FORHOLDSREGLER ].
I dyreforsøg resulterede subkutan administration af inoteren til gravide kaniner i for tidlig fødsel og reduceret føtal kropsvægt ved den højeste testede dosis, som var forbundet med moderlig toksicitet. Der blev ikke observeret negative udviklingseffekter, når Inoteren eller et farmakologisk aktivt surrogat blev administreret til gravide mus.
I den amerikanske generelle befolkning er den estimerede baggrundsrisiko for større fødselsdefekter og spontanabort i klinisk anerkendte graviditeter henholdsvis 2-4% og 15-20%. Baggrundsrisikoen for store fødselsdefekter og spontanabort for den angivne befolkning er ukendt.
Data
Dyredata
Subkutan administration af Inoteren (0 3 15 eller 25 mg/kg) eller en gnaverspecifik surrogat (15 mg/kg) til han- og hunmus hver anden dag før og under parring og fortsat i kvinder i hele den periode med organogenese gav ingen bivirkninger på embryofetal udvikling.
Subkutan administration af Inoteren (0 2,5 5 eller 15 mg/kg) til gravide kaniner hver anden dag i hele perioden med organogenese resulterede i for tidlig fødsel og reduceret føtal kropsvægt ved den højeste testede dosis, som var forbundet med mødrekosticitet (reduceret kropsvægt og fødevareforbrug).
Subkutan administration af Inotersen (0 2,9 11,4 eller 22,9 mg/kg) eller en gnaverspecifik surrogat (11,4 mg/kg) til mus hver anden dag gennem graviditet og amning gav ingen bivirkninger på før-eller postnatal udvikling.
Amning
Risikooversigt
Der er ingen oplysninger om tilstedeværelsen af Tegsedi i human mælk Virkningerne på det ammede spædbarn eller virkningerne på mælkeproduktionen. En undersøgelse i ammende mus har vist udskillelse af inoteren i mælk. Udviklingen og de sundhedsmæssige fordele ved amning bør overvejes sammen med mors kliniske behov for Tegsedi og eventuelle bivirkninger på det ammede spædbarn fra Tegsedi eller fra den underliggende moderlige tilstand.
Pædiatrisk brug
Sikkerhed og effektivitet hos pædiatriske patienter er ikke etableret.
Geriatrisk brug
Kliniske undersøgelser af Tegsedi inkluderede 69 patienter (45%) i alderen 65 år og derover. Der blev ikke observeret nogen forskelle i farmakokinetik eller effektivitet mellem disse patienter og yngre patienter. Patienter 65 år og ældre kan have en øget risiko for visse bivirkninger, såsom kongestiv hjertesvigt, kulderystelser myalgi og ekstremitetssmerter.
Nedskærmning af nyren
Ingen dosisjustering er nødvendig hos patienter med mild til moderat nedsat nyrefunktion (estimeret glomerulær filtreringshastighed [EGFR] ≥30 til <90 mL/min/1.73 m2) [Se Klinisk farmakologi ]. Tegnedi has not been studied in patients with severe renal impairment or end-stage renal disease.
Leverskrivning i leveren
Ingen dosisjustering er nødvendig hos patienter med mild leverafbrydning [se Klinisk farmakologi ]. Tegnedi has not been studied in patients with other degrees of hepatic impairment.
Overdoseringsoplysninger til Tegsedi
Ingen oplysninger leveret
Kontraindikationer for Tegsedi
Tegnedi is contraindicated in patients with:
- Blodpladetælling under 100 x 109/L [se ADVARSELS AND FORHOLDSREGLER ]
- Historie om akut glomerulonephritis forårsaget af Tegsedi [se ADVARSELS AND FORHOLDSREGLER ]
- Historie om en overfølsomhedsreaktion på Tegsedi [se ADVARSELS AND FORHOLDSREGLER ]
Klinisk farmakologi for Tegsedi
Handlingsmekanisme
Inoteren er et antisense-oligonukleotid, der forårsager nedbrydning af mutant og vildtype TTR-mRNA gennem binding til TTR-mRNA, hvilket resulterer i en reduktion af serum-TTR-protein- og TTR-proteinaflejringer i væv.
Farmakodynamik
De farmakodynamiske virkninger af Tegsedi blev evalueret hos HATTR -amyloidosepatienter behandlet med 284 mg Tegsedi via subkutan injektion en gang ugentligt.
Med gentagelsesdosering falder den gennemsnitlige procentdel fra baseline i serum TTR fra uge 13 til uge 65 af behandlingen varierede fra 68% til 74% (medianinterval: 75% til 79%). Lignende TTR -reduktioner blev observeret uanset TTR -mutationsexalder eller race.
Serum TTR er et bærer af retinolbindende protein, der er involveret i transport af vitamin A i blodet. Gennemsnitlige reduktioner i serumretinolbinding på 71% og serum -vitamin A på 63% blev observeret i uge 65 [se ADVARSELS AND FORHOLDSREGLER ].
Hjertelektrofysiologi
Formelle QTC -undersøgelser er ikke blevet udført med Tegsedi. Potentialet for QTC-forlængelse med Inoteren blev evalueret i et randomiseret placebokontrolleret forsøg hos raske frivillige. Ingen store ændringer i det gennemsnitlige QTC -interval (> 20 ms) blev påvist i forsøget.
I det 66-ugers kontrollerede effektivitetsforsøg havde 5,4% af TEGSEDI-behandlede patienter bevis for, at QRS forlænges på deres elektrokardiogrammer (EKG'er) til mere end 160 msek og større end 25% over baseline sammenlignet med og hos 1,7% af patienterne på placebo.
Farmakokinetik
Efter subkutan administration steg systemisk eksponering for Inoteren på en dosisproportional måde over området 150-400 mg inoteren-natriumsalt. Ved det anbefalede Tegsedi -doseringsregime på 284 mg hver uge nås stabil tilstand efter cirka 3 måneder. Det estimerede geometriske middelværdi (90% konfidensinterval) steady state topkoncentrationer (CMAX) -trugkoncentrationer (CTROUGH) og areal under kurven (AUCτ) var 6,39 (5,65 7,20) μg/ml 0,034 (0,031 0,038) μg/ml og 90 (82,4 97,4) μg · HL henholdsvis. Plasma Cmax og AUC udviser ikke akkumulering ved stabil tilstand.
Absorption
Efter subkutan administration absorberes Tegsedi hurtigt i systemisk cirkulation på en dosisafhængig måde med mediantiden til maksimale plasmakoncentrationer (Cmax) på 2 til 4 timer.
Fordeling
Tegsedi er meget bundet til humane plasmaproteiner (> 94%), og fraktionen bundet er uafhængig af lægemiddelkoncentration. Baseret på dyreforsøg (mus rotte og abe) distribuerer Tegsedi hurtigt bredt til væv med de højeste koncentrationer, der er observeret i nyren og leveren. Tegsedi krydser ikke blod-hjerne-barrieren. Den tilsyneladende mængde fordeling af Tegsedi ved stabil tilstand (gennemsnit og 90% konfidensinterval) er 293 (268 320) L hos patienter med HATTR.
Eliminering
Den terminale eliminering halveringstid (gennemsnit og 90% konfidensinterval) for Tegsedi er 32,3 (29,4 35,5) dage. Inoteren ryddes hovedsageligt gennem metabolisme, og den samlede kropsafstand (gennemsnit og 90% konfidensinterval) er 3,18 (3,08 3,29) L/h.
Metabolisme
Inoteren metaboliseres af nukleaser til nukleotider i forskellige længder.
Udskillelse
Mindre end 1% af den administrerede dosis af Inoteren udskilles uændret til urin inden for 24 timer.
Specifikke populationer
Aldersløb og køn havde ingen indflydelse på den stabile farmakokinetik for inoteren eller TTR -reduktion. Befolkningsfarmakokinetiske og farmakodynamiske analyser indikerede ingen indflydelse af mild eller moderat nyrefunktion (EGFR ≥30 til <90 mL/min/1.73 m2) eller mild leverfunktion (bilirubin mindre end eller lig med 1,5 x Uln og/eller AST mindre end 1,9 x Uln) på inoteren -eksponering eller TTR -reduktion. Tegsedi er ikke blevet undersøgt hos patienter med alvorlig nyrefunktionsafbrydelse af nyresygdommen moderat eller alvorlig leverfunktion eller hos patienter med tidligere levertransplantation.
Lægemiddelinteraktionsundersøgelser
Der er ikke udført nogen formelle kliniske lægemiddelinteraktionsundersøgelser. Tegsedi er ikke et substrat eller inhibitor/inducer af større CYP -enzymer eller et substrat eller inhibitor af større transportører. I en population af farmakokinetisk analyse påvirkede samtidig brug af diuretika -antithrombotiske og smertestillende midler ikke de farmakokinetiske parametre for inoteren. Tegsedi forventes ikke at forårsage medikament-lægemiddelinteraktioner eller blive påvirket af hæmmere eller inducerere af cytochrome P450-enzymer.
Kliniske studier
Effektiviteten af Tegsedi blev demonstreret i en randomiseret dobbeltblind placebokontrolleret multicenter klinisk forsøg hos voksne patienter med polyneuropati forårsaget af HATTR-amyloidose (undersøgelse 1; NCT 01737398). Patienter blev randomiseret i et forhold på 2: 1 for at modtage enten TEGSEDI (284 mg inoteren) (n = 113) eller placebo (n = 60) henholdsvis som en subkutan injektion, der blev administreret en gang om ugen i 65 uger (3 doser blev administreret i løbet af den første behandlingsuge). Seventoghalvfjerds procent af Tegsedi-behandlede patienter og 87% af patienterne på placebo afsluttede 66 uger af den tildelte behandling.
De co-primære effektivitetsendepunkter var ændringen fra baseline til uge 66 i den modificerede neuropati-svækkelse skala 7 (MNIS 7) sammensatte score og Norfolk-kvaliteten af livsdiabetisk neuropati (QOL-DN) total score.
MNIS 7 er en objektiv vurdering af neuropati og omfatter NIS og modificerede 7 sammensatte score. I versionen af MNIS 7, der er anvendt i forsøget, måler NIS objektivt underskud i kranial nervefunktionsmuskelstyrke reflekser og fornemmelser og den modificerede 7 vurderer hjerterytme respons på dyb vejrtrækning postural blodtryk kvantitativ sensorisk test (berøringspress og varmepain) og perifer nerve elektrofysiologi. Den maksimale mulige score var 346,32 point med højere score, der repræsenterede en større sværhedsgrad af sygdommen.
Den kliniske meningsfulde effekter på MNIS 7 blev vurderet ved ændringen fra baseline til uge 66 i Norfolk-kvaliteten af livsdiabetisk neuropati (QOL-DN) total score. Norfolk QOL-DN-skalaen er en patientrapporteret vurdering, der evaluerer den subjektive oplevelse af neuropati i følgende domæner: fysisk funktion/stor fiberneuropati-aktiviteter af daglige livs symptomer Små fiber neuropati og autonom neuropati. Den version af Norfolk QOL-DN, der blev brugt i forsøget, havde en maksimal mulig samlet score på 136 point med højere score, der repræsenterede større forringelse.
Ændringerne fra baseline til uge 66 på både MNIS 7 og Norfolk QOL-DN favoriserede Tegsedi signifikant (tabel 3 figur 1 og 3). Fordelingerne af ændringer i MNIS 7 og Norfolk QOL-DN-scoringer fra baseline til uge 66 til procent af patienterne er vist i henholdsvis figur 2 og figur 4.
Tabel 3: Klinisk effektivitet er resultatet af undersøgelse 1
| Slutpunkt | Baseline | Skift fra baseline til uge 66 (Ls middelværdi) | Tegnedi – placebo Treatment Difference LS Mean (95% der) | p-værdi | ||
| Tegnedi | Placebo | Tegnedi | Placebo | |||
| Primæra | ||||||
| 7.b c | 80.2 | 75.3 | 5.8 | 25.5 | -19.7 [-26.4 -13.0] | <0.001 |
| Norfolk Qol-Dnb d | 48.7 | 48.7 | 1.0 | 12.7 | -11.7 [-18.3 -5.1] | <0.001 |
| CI -konfidensinterval; Ls mindst firkanter; MNIS modificeret neuropati svækkelse score; QOL-DN livskvalitet-diabetisk neuropati a Alle slutpunkter analyseret ved hjælp af metoden med blandet effekt-model gentagne mål (MMRM). b En lavere værdi indikerer mindre svækkelse/færre symptomer. c Den primære analysepopulation for MNIS 7 -analysen inkluderede N = 95 TEGSEDI -patienter og N = 56 placebo -patienter d Den primære analysepopulation for Norfolk QOL-DN-analysen inkluderede N = 94 TEGSEDI-patienter og N = 57 placebo-patienter |
Figur 1: Skift fra baseline i MNIS 7
Figur 2: Histogram af MNIS 7 Ændring fra baseline i uge 66
Figur 3: Skift fra baseline i Norfolk QOL-DN score
Figur 4: Histogram af Norfolk QOL-DN skift fra baseline i uge 66
Patienter, der modtog TEGSEDI, oplevede lignende forbedringer i forhold til placebo i MNIS 7 og Norfolk QOL-DN-score på tværs af alle undergrupper inklusive alderssex race-region NIS-score Val30met-mutationsstatus og sygdomsstadium.
Patientinformation til Tegsedi
Tegnedi
(Teg-sed-ee)
(Inotersen) Injektion til subkutan brug
Hvad er de vigtigste oplysninger, jeg skal vide om Tegsedi?
Tegnedi can cause serious side effects including:
- Lavt blodpladetællinger (thrombocytopeni). Tegnedi may cause the number of platelets in your blood to be reduced at any time during treatment. This is a common side effect of Tegnedi. When your platelet count is too low your body cannot form clots. You could have serious bleeding that could lead to death. Ring straks din sundhedsudbyder, hvis du har det:
- Usædvanlige blå mærker eller et udslæt af små rødlige-lilla pletter ofte på underbenene
- blødning fra hudskæringer, der ikke stopper eller oser
- Blødning fra dit tandkød eller næsen
- blod i din urin eller afføring
- Blødning ind i de hvide i dine øjne
- Pludselig alvorlig hovedpine eller nakkestivhed
- opkast or Hoste blod
- unormale eller tunge perioder (menstruationsblødning)
- nyreinflammation (glomerulonephritis). Dine nyrer kan stoppe med at fungere korrekt. Glomerulonephritis kan føre til alvorlig nyreskade og nyresvigt, der har brug for dialyse. Ring straks din sundhedsudbyder, hvis du har det:
- puffiness eller hævelse i dine ansigtsfødder eller hænder
- Ny begyndelse eller forværring af åndenød og hoste
- blod i din urin eller brun urin
- Skumy urin (proteinuri)
- passeret mindre urin end normalt
Din sundhedsudbyder udfører laboratorieundersøgelser for at kontrollere dit blodpladetælling og nyrer, inden du starter Tegsedi, og mens du bruger det. Din sundhedsudbyder skal også udføre laboratorieundersøgelser i 8 uger efter, at du stopper Tegsedi. Det er vigtigt, at du sørger for, at du får disse laboratorieundersøgelser udført.
- På grund af risikoen for alvorlig blødning forårsaget af lavt blodpladetællinger, og på grund af risikoen for nyreproblemer er Tegsedi kun tilgængelig gennem et begrænset program kaldet Tegsedi Risk Evaluation andMitigation (REMS) -programmet.
- Før du begynder at bruge Tegsedi, skal du tilmelde dig TEGSEDI REMS -programmet. Tal med din sundhedsudbyder om, hvordan du tilmelder dig TEGSEDI REMS -programmet.
- Du skal acceptere at få din laboratorietest udført, mens du er i Tegsedi REMS -programmet.
- Du kan kun få Tegsedi fra et certificeret apotek, der deltager i Tegsedi REMS -programmet. Din sundhedsudbyder kan give dig oplysninger om, hvordan du finder et certificeret apotek.
- For mere information inklusive en liste over certificerede apoteker, gå til www.tegsedirems.com eller ring 1-844-4834736.
Hvad er Tegsedi?
Tegnedi is a medicine used to treat the polyneuropathy of hereditary transthyretin-mediated (hATTR) amyloidosis in adults. It is not known if Tegnedi is safe og effective in children.
Brug ikke Tegsedi, hvis du har det:
- En blodpladetælling, der er lav.
- Havde nyrebetændelse (glomerulonephritis) forårsaget af Tegsedi.
- Havde en allergisk reaktion på Inoteren eller nogen af ingredienserne i Tegsedi. Se slutningen af denne medicinvejledning for en komplet liste over ingredienser i Tegsedi.
Før du begynder at bruge Tegsedi, fortæl din sundhedsudbyder om alle dine medicinske tilstande, herunder hvis du:
- har eller havde blødningsproblemer
- har eller haft nyreproblemer
- har modtaget en levertransplantation
- er gravide eller planlægger at blive gravid. Det vides ikke, om Tegsedi kan skade din ufødte baby.
- Der er et register for kvinder, der bliver gravide under behandling med Tegsedi. Hvis du bliver gravid, mens du tager Tegsedi, skal du tale med din sundhedsudbyder om at registrere sig hos Tegsedi Graviditetseksponeringsregister. Formålet med dette register er at indsamle information om dit helbred og din babys helbred. Du kan få mere information om dette register ved at ringe: 1-877-465-7510 E-mailing: [E -mail eller besøger online på: www.tegsedipregnancystudy.com.
- er amning eller planlægger at amme. Det vides ikke, om Tegsedi kan passere ind i din modermælk eller skade din baby. Tal med din sundhedsudbyder om den bedste måde at fodre din baby på, mens du bruger Tegsedi.
Fortæl din sundhedsudbyder om alle de medicin, du tager, herunder recept- og over-the-counter medicin vitaminer og urtetilskud.
Fortæl især din sundhedsudbyder, hvis du tager:
- A-vitamin eller beta-carotentilskud. Din sundhedsudbyder skal bede dig om at tage vitamin A, men kun tage det beløb, de fortæller dig at tage.
- Blodfortyndere (antikoagulantia) eller medicin, der påvirker blodkoagulation.
Spørg din sundhedsudbyder eller farmaceut, om du ikke er sikker på, om du tager nogen af disse medicin. Kend de medicin, du tager. Opbevar en liste over dem for at vise din sundhedsudbyder eller apotek, når du får en ny medicin.
Hvordan skal jeg bruge Tegsedi?
- Læs de detaljerede instruktioner til brug, der følger med din Tegsedi.
- Din sundhedsudbyder viser dig eller din plejeperson, hvordan du injicerer Tegsedi første gang.
- Hvis du eller din plejeperson har spørgsmål, skal du stille din sundhedsudbyder.
- Tegnedi is injected under your skin (subcutaneously) in your stomach area (abdomen) or the front of your upper legs (thighs) by you or a caregiver. A caregiver may also give you an injection of Tegnedi in the outer area of your upper arm.
- Gør ikke Injekt på det samme sted hver gang.
- Gør ikke Injekt i det 2-tommer område omkring maveknappen (flåde).
- Gør ikke Injekt, hvor huden er mærket mørt og hårdt.
- Gør ikke Injekt i områder med ar eller tatoveringer.
- Gør ikke Injekt gennem tøj.
- Følg din sundhedsudbyders instruktioner om, hvornår du skal injicere Tegsedi.
- Tegnedi should be injected 1 time each week on the same day.
- Hvis du går glip af en dosis, skal du tage den ubesvarede dosis så hurtigt som muligt, medmindre din næste planlagte dosis er inden for 2 dage. Hvis din næste planlagte dosis er inden for 2 dage, skal du springe over den ubesvarede dosis og tage din næste planlagte dosis på den planlagte dag.
Hvad er mulige bivirkninger af Tegsedi?
Tegnedi may cause serious side effects including:
- Se Hvad er de vigtigste oplysninger, jeg skal vide om Tegsedi?
- Slag. Tegnedi may cause a Slag. One person taking Tegnedi had a Slag which occurred within 2 days after the first dose. Signs or symptoms of Slag may include:
- Pludselig følelsesløshed eller svaghed, især på den ene side af kroppen
- Alvorlig hovedpine or nakkesmerter
- forvirring
- Problemer med synstale eller balance
- Droopy øjenlåg
Få nødhjælp med det samme, hvis du har symptomer på slagtilfælde.
bivirkninger af synthroid 75 mg
- Problemer med inflammatoriske og immunsystem. Nogle mennesker, der tog Tegsedi, havde alvorlige inflammatoriske og immunsystemproblemer. Symptomer på inflammatoriske og immunsystemproblemer omfattede uventet ændring i vandresvaghed og spasmer i benene på rygsmerter vægttab Hovedpine opkast og problemer med tale.
- levereffekter. Tegnedi may cause liver problems. Your healthcare provider should do laboratory tests to check your liver before you start Tegnedi og while you are using it. Tell your healthcare provider if you have symptoms that your liver may not be working right which could include unexpected kvalme og opkast stomach smerte being not hungry yellowing of the skin or having Mørk urin.
- Allergiske reaktioner. Tegnedi may cause serious Allergiske reaktioner. These allergic reactions often occur within 2 hours after injecting Tegnedi. Get emergency help immediately if you have any symptoms of an allergic reaction including:
- ledssmerter
- brystsmerter
- højt blodtryk
- kulderystelser
- Skylning
- Sværheds vanskeligheder
- rødme on palms of hogs
- rysten eller rykkende bevægelser
- Muskelsmerter
- influenza-lignende symptomer
- Øjenproblemer (lavt vitamin A -niveau). Behandling med Tegsedi vil sænke vitamin A -niveauerne i dit blod. Din sundhedsudbyder skal bede dig om at tage A -vitamin -tilskud, mens du bruger Tegsedi. Din sundhedsudbyder fortæller dig, hvor meget du skal tage. Ring til din sundhedsudbyder, hvis du får øjenproblemer, såsom at have svært ved at se om natten eller i områder med lavt oplyste områder ( Natblindhed ). Din sundhedsudbyder skal sende dig for at se en øjenlæge (øjenlæge).
De mest almindelige bivirkninger af Tegsedi inkluderer: Reaktioner på injektionsstedet (såsom rødme eller smerter på injektionsstedet) Kvalme hovedpine træthed Lav blodpladetællinger (thrombocytopeni) og feber.
Dette er ikke alle de mulige bivirkninger af Tegsedi.
Ring til din læge for medicinsk rådgivning om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare Tegsedi?
- Opbevar Tegsedi i køleskabet mellem 36 ° F til 46 ° C (2 ° C (2 ° C) i den originale beholder.
- Gør ikke fryse.
- Tegnedi prefilled syringes can also be kept at room temperature that is no higher than 86°F (30°C) in the original container for up to 6 weeks.
- Gør ikke Lad Tegsedi nå temperaturer over 30 ° C (30 ° C).
- Hvis du ikke bruger Tegsedi, der holdes ved stuetemperatur inden for 6 uger, kaster det den væk.
- Beskyt mod lys.
Hold Tegsedi og alle medicin uden for børns rækkevidde.
Generel information om sikker og effektiv anvendelse af Tegsedi
Medicin er undertiden ordineret til andre formål end dem, der er anført i en medicinguide. Brug ikke Tegsedi til en betingelse, som den ikke er ordineret til. Giv ikke Tegsedi til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem. Du kan bede din farmaceut eller sundhedsudbyder om information om Tegsedi, der blev skrevet til sundhedsfagfolk.
Hvad er ingredienserne i Tegsedi? Aktive ingredienser: Inoteren
Inaktive ingredienser: Oprenset vand (vand til injektion) saltsyre og eller natriumhydroxid til pH -justering
Denne medicinguide er godkendt af U.S. Food and Drug Administration.