Sol
Oplysningerne På Webstedet Er Ikke Medicinsk Rådgivning. Vi Sælger Ikke Noget. Nøjagtigheden Af Oversættelsen Er Ikke Garanteret. Ansvarsfraskrivelse
Resume af lægemiddeloversigt
Hvad er solenergien?
Soliqua 100/33 (insulin glargine og lixisenatidinjektion) er en kombination af en langtidsvirkende human insulinanalog med en Glucagon -lignende peptid -1 (GLP -1) receptoragonist indikeret som et supplement til diæt og motion for at forbedre glykæmisk kontrol hos voksne med type 2 Diabetes mellitus utilstrækkeligt kontrolleret på basal insulin (mindre end 60 enheder dagligt) eller lixisenatid.
Hvad er bivirkninger af Soliqua?
Sol
- elveblest
- Besvær
- Hævelse af dine ansigtslæber tunge eller hals
- Mave- eller mavesmerter
- Agitation
- oppustethed
- sløret vision
- øget vandladning
- dårlig fordøjelse
- uregelmæssig hjerteslag
- irritabilitet
- kulderystelser
- Kold sved
- Blamme hud
- koma
- træthed
- Lightheadedness
- Tab af bevidsthed
- forvirring
- forstoppelse
- kramper
- muskelsmerter eller kramper
- Tab af appetit
- Cool eller lys hud
- hoste
- Muskeltrækning
- kvalme
- opkast
- mareridt
- lidt eller ingen vandladning
- Sværheds vanskeligheder
- svimmelhed
- Støjende vejrtrækning
- følelsesløshed eller prikken i hænderne fødder eller læber
- Lightheadedness
- mavesmerter, der stråler mod ryggen
- Hurtig eller svag hjerteslag
- tør mund
- feber
- Skyllet tør hud
- Frugtlignende åndedræts lugt
- hovedpine
- kløe
- udslæt
- fjendtlighed
- øget tørst
- øget sult
- Hævelse af øjenlågene eller omkring øjnene ansigt læber eller tunge
- Hurtig vægtøgning
- sløret tale
- Stupor
- sved
- Tæthed i brystet
- problemer med at trække vejret
- uforklarlig vægttab
- træthed
- svaghed og
- Gulning af huden eller øjnene (gulsot)
Få medicinsk hjælp med det samme, hvis du har nogen af de symptomer, der er anført ovenfor.
Almindelige bivirkninger af Soliary 100/33 inkluderer:
- lavt blodsukker ( Hypoglykæmi )
- Allergiske reaktioner
- kvalme
- løbende eller Snerpet næse
- diarre
- Infektion i øvre luftvejsinfektion
- hovedpine
- reaktioner på injektionsstedet (hævelse af rødme kløe smerter hud misfarvning varme og en hård klump)
- Hævelse af ekstremiteterne
- vægtøgning
- opkast
- forstoppelse
- dårlig fordøjelse
- ked af maven
- mavesmerter
- gas
- gastroesophageal reflux Sygdom (GERD)
- oppustethed og
- nedsat appetit.
Ring til din læge med det samme, hvis du har følgende alvorlige bivirkninger:
- sløret vision tunnel vision eye pain or swelling or seeing halos around lights;
- Hurtige eller dunkende hjerteslag, der flagrer i din brystkort af åndedrættet og pludselig svimmelhed;
- Lave niveauer af natrium i kroppen med svær hovedpine forvirring sløret tale alvorlig svaghed opkastning af tab af koordinationsfølelse ustabil; eller
- Alvorlig nervesystemreaktion med meget stive (stive) muskler med høj feber svedende forvirring Hurtig eller ujævne hjerteslag ryster og føles som om du måske går ud.
Søg medicinsk behandling eller ring 911 på én gang, hvis du har følgende alvorlige bivirkninger:
- Alvorlige øjensymptomer såsom pludseligt synstab sløret synet tunnel vision øje smerter eller hævelse eller at se haloer omkring lys;
- Alvorlige hjertesymptomer såsom hurtig uregelmæssige eller bankende hjerteslag; flagrende i brystet; åndenød; og pludselig svimmelhed lethed eller udlevering;
- Alvorlig hovedpine forvirring sløret talearm eller ben svaghed problemer med at gå tab af koordination føles ustabil meget stive muskler høj feber voldsom sved eller rysten.
Dette dokument indeholder ikke alle mulige bivirkninger, og andre kan forekomme. Kontakt din læge for yderligere oplysninger om bivirkninger.
Dosering til Soliqua
Hos patienter kontrolleres utilstrækkeligt på mindre end 30 enheder basal insulin eller på lixisenatid, startdoseringen af Soliqua 100/33 er 15 enheder (15 enheder insulin glargine/5 mcg lixisenatid) givet subkutant en gang dagligt. Hos patienter kontrolleres utilstrækkeligt på 30 til 60 enheder basal insulin, som startdoseringen af Soliqua 100/33 er 30 enheder (30 enheder insulin glargine/10 mcg lixisenatid) givet subkutant en gang dagligt.
Hvilke stoffer stoffer eller kosttilskud interagerer med Soliqua?
Soliqua 100/33 kan interagere med andre antidiabetika ACE -hæmmere Angiotensin II -receptorblokkere Disopyramid Fibrater Fluoxetin Monoaminoxidaseinhibitorer Pentoxifylline Pramlintidpropoxyphen Salicylater Somatostatin Analoger Sulfonamid Antibiotika Atypiske antipsykotika Kortikosteroider Danazol diuretika østrogener Glucagon isoniazid niacin oral contraceptives phenothiazines progestogens protease inhibitors somatropin sympathomimetics thyroid hormones alcohol beta-blockers clonidine lithium Saltpentamidin -klonidin -guanethidin og reserpin. Fortæl din læge alle medicin og kosttilskud, du bruger.
Soliqua under graviditet eller amning
Fortæl din læge, hvis du er gravid eller planlægger at blive gravid, før du bruger Soliqua 100/33; Det kan skade et foster. Det er ukendt, om Soliqua 100/33 passerer til modermælk. Kontakt din læge inden amning.
Yderligere oplysninger
Vores Soliqua 100/33 (Insulin Glargine og Lixisenatide -injektion) Bivirkninger Drug Center giver et omfattende overblik over tilgængelige lægemiddelinformation om de potentielle bivirkninger, når du tager denne medicin.
FDA -lægemiddelinformation
- Lægemiddelbeskrivelse
- Indikationer
- Dosering
- Bivirkninger
- Lægemiddelinteraktioner
- Advarsler
- Overdosis
- Klinisk farmakologi
- Medicin vejledning
Beskrivelse til Soliqua -injektion
Soliqua 100/33 (insulin glargine og lixisenatidinjektion) til subkutan anvendelse er en kombination af et langtidsvirkende basal insulinanalog insulin glargine og en GLP-1 receptoragonist loxisenatid.
Hver Soliqua 100/33 Forparede en-patient-engangspen indeholder 300 enheder insulin-glargin og 100 mcg lixisenatid i 3 ml af en klar farveløs til næsten farveløs steril og vandig opløsning. Hver ml opløsning indeholder 100 enheder insulin glargine og 33 mcg lixisenatid.
Soliqua 100/33 indeholder følgende inaktive ingredienser (pr. Ml): 3 mg methionin 2,7 mg metacresol 20 mg glycerol 30 mcg zinkhydrochlorsyre -natriumhydroxid og vand til injektion som inaktive ingredienser.
Insulin glargine
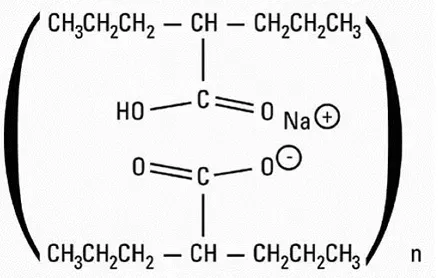
Insulin glargine er en human insulinanalog produceret ved rekombinant DNA-teknologi ved anvendelse af en ikke-patogen laboratoriebelastning af De udstillede chill (K12) som produktionsorganisme. Insulin-glargin adskiller sig fra humant insulin, idet aminosyren asparagin ved position A21 erstattes af glycin, og to argininer tilsættes ved C-terminalen i B-kæden. Insulin -glargin har lav vandig opløselighed ved neutral pH. Ved pH 4 er insulin glargine helt opløselig. Kemisk insulin glargine er 21A-Gly-30BA-L-Arg-30BB-L-arg-menneskelig insulin og har den empiriske formel c267H404N72O78S6 og en molekylvægt på 6063. Insulin -glargine har følgende strukturelle formel:
 |
Lixisenatid
Lixisenatid is a synthetic analogue of human GLP-1 which acts as a GLP-1 receptor agonist. Lixisenatid is a peptide containing 44 amino acids which is amidated at the C-terminal amino acid (position 44). The order of the amino acids is given in the figure below. Its molecular weight is 4858.5 og the empirical formula is C215H347N61O65S med følgende kemiske struktur:
 |
Anvendelser til solinjektion
Soliqua 100/33 er en kombination af insulin glargine og lixisenatid og er indikeret som et supplement til diæt og træning for at forbedre glykæmisk kontrol hos voksne med type 2 -diabetes mellitus.
Begrænsninger af brug
- Soliqua 100/33 er ikke undersøgt hos patienter med en historie med pancreatitis [se Advarsler og forholdsregler ]. Overvej andre antidiabetiske terapier hos patienter med en historie med pancreatitis.
- Soliqua 100/33 anbefales ikke til brug i kombination med noget andet produkt, der indeholder en GLP-1-receptoragonist [se Advarsler og forholdsregler ].
- Soliqua 100/33 er ikke indikeret til anvendelse hos patienter med type 1 -diabetes mellitus eller til behandling af diabetisk ketoacidose.
- Soliqua 100/33 er ikke undersøgt hos patienter med gastroparese og anbefales ikke hos patienter med gastroparese.
- Soliqua 100/33 er ikke undersøgt i kombination med prandial insulin.
Dosering til Soliqua Indsprøjtning
Vigtige doseringsoplysninger
- Soliqua 100/33 er en kombination af insulin glargine og lixisenatid.
- Administrer Soliqua 100/33 subkutant en gang om dagen inden for en time før det første måltid på dagen.
- Soliqua 100/33 pen leverer doser fra 15 til 60 enheder i en enkelt injektion. Tabel 1 viser enhederne af insulin glargine og mikrogrammerne af lixisenatid i hver dosering af Soliqua 100/33 [se Dosering og administration ].
- Den maksimale dosis Soliqua 100/33 er 60 enheder dagligt (60 enheder insulin glargine og 20 mcg lixisenatid) [se Advarsler og forholdsregler ].
Anbefalet startdosis
Hos patienter naiv til basal insulin eller til en GLP-1-receptoragonist i øjeblikket på en GLP-1-receptoragonist eller i øjeblikket på mindre end 30 enheder basal insulin dagligt:
- Afbryd terapi med basal insulin eller en GLP-1-receptoragonist inden påbegyndelse af Soliqua 100/33.
- Den anbefalede startdosering af Soliqua 100/33 er 15 enheder (15 enheder insulin glargine og 5 mcg lixisenatid) givet subkutant en gang dagligt.
Hos patienter i øjeblikket på 30 til 60 enheder af basal insulin dagligt med eller uden en GLP-1-receptoragonist:
- Afbryd terapi med basal insulin eller GLP-1 receptoragonist inden påbegyndelse af Soliqua 100/33.
Den anbefalede startdosis af Soliqua 100/33 er 30 enheder (30 enheder insulin glargine og 10 mcg lixisenatid) givet subkutant en gang dagligt.
Tabel 1: Enheder med insulin glargin og mikrogram lixisenatid i hver dosering af Soliqua 100/33
| Soliqua 100/33 (dosisvindue display)* | Insulin glargine komponent dosis | Lixisenatid component dose | Kommentar |
| 2 | --- | --- | Sikkerhedstestdosis - ikke til injektion |
| 15 | 15 enheder | 5 mcg | Anbefalet startdosering til patienter naiv til basal insulin eller GLP-1 receptoragonist i øjeblikket på GLP-1 receptoragonist eller i øjeblikket på mindre end 30 enheder basal insulin dagligt |
| 16 | 16 enheder | 5,3 mcg | |
| 17 | 17 enheder | 5,7 mcg | |
| 18 | 18 enheder | 6 mcg | |
| 19 | 19 enheder | 6,3 mcg | |
| 20 | 20 enheder | 6,7 mcg | |
| 21 | 21 enheder | 7 mcg | |
| 22 | 22 enheder | 7.3 mcg | |
| 23 | 23 enheder | 7,7 mcg | |
| 24 | 24 enheder | 8 mcg | |
| 25 | 25 enheder | 8,3 mcg | |
| 26 | 26 enheder | 8,7 mcg | |
| 27 | 27 enheder | 9 mcg | |
| 28 | 28 enheder | 9,3 mcg | |
| 29 | 29 enheder | 9,7 mcg | |
| 30 | 30 enheder | 10 mcg | Anbefalet startdosering til patienter, der i øjeblikket er på 30 til 60 enheder basalinsulin dagligt med eller uden en GLP-1-receptoragonist: |
| 31 | 31 enheder | 10,3 mcg | |
| 32 | 32 enheder | 10,7 mcg | |
| 33 | 33 enheder | 11 mcg | |
| 34 | 34 enheder | 11,3 mcg | |
| 35 | 35 enheder | 11,7 mcg | |
| 36 | 36 enheder | 12 mcg | |
| 37 | 37 enheder | 12,3 mcg | |
| 38 | 38 enheder | 12,7 mcg | |
| 39 | 39 enheder | 13 mcg | |
| 40 | 40 enheder | 13,3 mcg | |
| 41 | 41 enheder | 13,7 mcg | |
| 42 | 42 enheder | 14 mcg | |
| 43 | 43 enheder | 14,3 mcg | |
| 44 | 44 enheder | 14,7 mcg | |
| 45 | 45 enheder | 15 mcg | |
| 46 | 46 enheder | 15,3 mcg | |
| 47 | 47 enheder | 15,7 mcg | |
| 48 | 48 enheder | 16 mcg | |
| 49 | 49 enheder | 16,3 mcg | |
| 50 | 50 enheder | 16,7 mcg | |
| 51 | 51 enheder | 17 mcg | |
| 52 | 52 enheder | 17,3 mcg | |
| 53 | 53 enheder | 17,7 mcg | |
| 54 | 54 enheder | 18 mcg | |
| 55 | 55 enheder | 18,3 mcg | |
| 56 | 56 enheder | 18,7 mcg | |
| 57 | 57 enheder | 19 mcg | |
| 58 | 58 enheder | 19,3 mcg | |
| 59 | 59 enheder | 19,7 mcg | |
| 60 | 60 enheder | 20 mcg | Maksimal daglig dosering [se Advarsler og forholdsregler ] |
| * Dosisvinduet på Soliqua 100/33 pen viser numre for de jævne enheder og viser linjer for de ulige enheder. |
Titrering af Soliqua 100/33
- Efter at have startet med den anbefalede dosering af Soliqua 100/33 [se Dosering og administration ] Titrat doseringen opad eller nedad med to til fire enheder (se tabel 2) hver uge baseret på patientens metaboliske behov for blodglukoseovervågningsresultater og glykæmisk kontrolmål, indtil den ønskede fastende plasmaglukose opnås.
- For at minimere risikoen for hypoglykæmi eller hyperglykæmi kan der være behov for yderligere titrering med ændringer i mønstre i fysisk aktivitet (dvs. makronæringsstofindhold eller timing af fødeindtag) eller nyre- eller leverfunktion; under akut sygdom; eller når det bruges sammen med andre medicin [se Advarsler og forholdsregler og Lægemiddelinteraktioner ].
Tabel 2: Anbefalet titrering af Soliqua 100/33 (hver uge)*
| Selvovervåget fastende plasmaglukose | Kontakt 100/33 doseringsjustering |
| Over målområdet | 2 enheder (2 enheder med insulin glargine og 0,66 mcg lixisenatid) til 4 enheder (4 enheder insulin glargine og 1,32 mcg lixisenatid) |
| Inden for målområdet | 0 enheder |
| Under målområdet | -2 enheder (2 enheder insulin glargine og 0,66 mcg lixisenatid) til -4 enheder (4 enheder insulin glargine og 1,32 mcg lixisenatid) |
| * Den anbefalede Soliqua 100/33 dosering er mellem 15 til 60 enheder (se tabel 1). |
Savne doser
Instruer patienter, der går glip af en dosis Soliqua 100/33 for at genoptage det engang daglige regime som foreskrevet med den næste planlagte dosis. Administrer ikke en ekstra dosis eller øg dosis for at kompensere for den ubesvarede dosis.
Vigtige administrationsinstruktioner
- Soliqua 100/33 Præfyldt pen er kun til engangsbrug Advarsler og forholdsregler ].
- Tog patienter til korrekt brug og injektionsteknik, inden de initierer Soliqua 100/33.
- Kontroller altid Soliqua 100/33 -mærket før administration [se Advarsler og forholdsregler ].
- Undersøg visuelt for partikler og misfarvning inden administration. Brug kun Soliqua 100/33, hvis opløsningen er klar og farveløs til næsten farveløs.
- Injicer Soliqua 100/33 subkutant i det lår i abdominalområdet eller overarmen.
- Drej injektionssteder inden for den samme region fra en injektion til den næste for at reducere risikoen for lipodystrofi og lokal kutan amyloidose. Injicer ikke i områder med lipodystrofi eller lokaliseret kutan amyloidose [se Advarsler og forholdsregler Bivirkninger ].
- Under ændringer til en patients insulinregime øger hyppigheden af blodsukkerovervågning [Se Advarsler og forholdsregler ].
- Administrer ikke intravenøst eller via en insulinpumpe.
- Brug Soliqua 100/33 med forsigtighed hos patienter med synshandicap, der kan stole på hørbare klik for at ringe til deres dosis.
- Soliqua 100/33 pen-urskiver i trin på 1 enhed.
- Fortynd eller bland ikke Soliqua 100/33 med nogen anden insulin eller opløsning.
- Opdel ikke dosis af Soliqua 100/33.
Hvor leveret
Dosering Forms And Strengths
12 eller 123 er en klar farveløs til næsten farveløs løsning tilgængelig som:
Indsprøjtning : 100 enheder insulin glargine og 33 mcg lixisenatid pr. Ml i en 3 ml forudfyldt engangs-engangs-brug Solostar®-pen.
Opbevaring og håndtering
12 eller 123 (Insulin glargine og lixisenatid) injektion er en klar farveløs til næsten farveløs opløsning i en 3 ml-præfyldt engangs-enkeltpatient-brug pen:
| Dosering Unit/Strength | Pakningstørrelse | NDC |
| 3 ml Soliqua 100/33 Enkeltpatient-brug pen 100 enheder/ml insulin glargine og 33 mcg/ml lixisenatid | Pakke med 5 | 0024-5761-05 |
Nåle er ikke inkluderet. Brug kun nåle, der er kompatible til brug med Soliqua 100/33, præfyldt pen.
Opbevaring
Dispens i den originale forseglede karton med de lukkede instruktioner til brug.
Før første brug skal Soliqua 100/33 pen opbevares i et køleskab 36 ° F-46 ° F (2 ° C (2 ° C). Frys ikke. Kasser Soliqua 100/33, hvis det er frosset. Beskyt mod lys.
Efter første brug butik ved stuetemperatur op til 25 ° C (25 ° C). Udskift pennehætten efter hver brug for at beskytte mod lys. Kasser Pen 28 dage efter første brug.
Fjern nålen efter hver injektion, og opbevar Soliqua 100/33 pen uden en nål fastgjort.
Fremstillet af: Sanofi-Aventis U.S. LLC Bridgewater NJ 08807 A Sanofi Company. Revideret: Nov 2024
Bivirkninger for Soliqua Indsprøjtning
Følgende bivirkninger diskuteres andetsteds:
- Anafylaksi og alvorlige overfølsomhedsreaktioner [se Advarsler og forholdsregler ]
- Pancreatitis [se Advarsler og forholdsregler ]
- Hypoglykæmi [se Advarsler og forholdsregler ]
- Akut nyreskade [se Advarsler og forholdsregler ]
- Hypokalæmi [se Advarsler og forholdsregler ]
- Akut galdeblære sygdom [se Advarsler og forholdsregler ]
- Pulmonal aspiration under generel anæstesi eller dyb sedation [se Advarsler og forholdsregler ]
Kliniske forsøg oplever
Fordi kliniske forsøg udføres under vidt forskellige tilstande, kan der ikke sammenlignes med vidt forskellige tilstande, der er observeret i kliniske forsøg med et lægemiddel, ikke direkte sammenlignet med hastigheder i det kliniske forsøg med et andet lægemiddel og muligvis ikke afspejler de satser, der er observeret i praksis.
Soliqua 100/33 (N = 834 med en gennemsnitlig behandlingsvarighed på 203 dage) er blevet evalueret i to kliniske studier (30 ugers varighed) hos patienter med diabetes af type 2. Undersøgelserne studerer A og B [se Kliniske studier ] Havde følgende egenskaber: Middelalderen var cirka 59 år; Cirka 50% var mandlige 90% var kaukasiske 6% var sorte eller afroamerikanske og 18% var latinamerikanske. Den gennemsnitlige varighed af diabetes var 10,3 år gennemsnitlige HbA1c ved screening for undersøgelse A var 8,2 og undersøgelse B var 8,5. Den gennemsnitlige BMI ved baseline var 32 kg/m². Baseline EGFR var ≥60 ml/min i 87,2% af den samlede studiepopulation, og den gennemsnitlige baseline EGFR var 83,0 ml/min/1,73 m².
Tabel 3: Bivirkninger, der forekommer i ≥5% af Soliqua 100/33 - behandlede patienter med type 2 -diabetes mellitus fra to samlede kliniske forsøg
| 12 eller 123 % (n = 834) | |
| Kvalme | 10.0 |
| Nasopharyngitis | 7.0 |
| Diarre | 7.0 |
| Infektion i øvre luftvejsinfektion | 5.5 |
| Hovedpine | 5.4 |
Hypoglykæmi
Hypoglykæmi is the most commonly observed adverse reaction in patients using insulin og insulin-containing products including 12 eller 123 [se Advarsler og forholdsregler ]. The rates of reported Hypoglykæmi depend on the definition of Hypoglykæmi used diabetes type insulin dose intensity of glucose control background therapies og other intrinsic og extrinsic patient factors. For these reasons comparing rates of Hypoglykæmi in clinical trials for 12 eller 123 with the incidence of Hypoglykæmi for other products may be misleading og also may not be representative of Hypoglykæmi rates that will occur in clinical practice.
I Soliqua 100/33-programmet blev alvorlig hypoglykæmi defineret som en begivenhed, der krævede hjælp fra en anden person til aktivt at administrere kulhydratglucagon eller andre genoplivende handlinger og dokumenteret symptomatisk hypoglykæmi blev defineret som en hændelse med typiske symptomer af hypoglykæmi ledsaget af et selvmonoreret plasma glucose-værdi svarende til eller mindre end 70 mg/dL (se tab 4).
Ingen klinisk vigtige forskelle i risiko for alvorlig hypoglykæmi mellem Soliqua 100/33 og komparatorer blev observeret i kliniske forsøg.
Tabel 4: Hypoglykæmiske episoder i Soliqua 100/33 -behandlede patienter med T2DM
| 12 eller 123 Study A N = 469 | 12 eller 123 Study B N = 365 | |
| Alvorlig symptomatisk hypoglykæmi* (%) | 0 | 1.1 |
| Hypoglykæmi (self-monitored plasma glucose <54 mg/dL) (%) | 8.1 | 17.8 |
| * Defineret som en begivenhed, der kræver hjælp fra en anden person til aktivt at administrere kulhydratglucagon eller andre genoplivende handlinger. |
Gastrointestinale bivirkninger
Gastrointestinale bivirkninger er den mest almindeligt observerede bivirkning hos patienter, der bruger lixisenatid. Gastrointestinale bivirkninger forekommer hyppigere i begyndelsen af Soliqua 100/33 terapi. Gastrointestinale bivirkninger, herunder kvalme af kvalme diarré, opkast forstoppelse dyspepsi gastritis abdominal smerte flatulence gastroøsofageal reflukssygdom abdominal distension og nedsat appetit er rapporteret hos patienter behandlet med Soliqua 100/33.
Bupropion HCL XL 150 mg anmeldelser
I undersøgelsen var en opkast 6,4% hos de lixisenatid -behandlede patienter mod 3,2% i Soliqua 100/33 - behandlede patienter og 1,5% i insulin -glargine - behandlede patienter; Kvalme var 24% hos de lixisenatid -behandlede patienter mod 9,6% i Soliqua 100/33 - behandlede patienter og 3,6% i insulin -glargine -behandlede patienter.
Lipodystrofi
Administration af insulin subkutant inklusive Soliqua 100/33 har resulteret i lipoatrofi (depression i huden) eller lipohypertrofi (udvidelse eller fortykning af væv) hos nogle patienter [se Dosering og administration ].
Anafylaksi og overfølsomhed
Lixisenatid
I Lixisenatid -udviklingsprogrammet blev anafylaksis -tilfælde bedømt. Anaphylaxis blev defineret som en hud- eller slimhindelæsion af akut begyndelse forbundet med mindst 1 andet organdsysteminddragelse. Symptomer som hypotension laryngeal ødem eller alvorlig bronchospasme kunne være til stede, men var ikke påkrævet til sagsdefinitionen. Flere tilfælde, der dømmes som at møde definitionen for anafylaksi, forekom hos lixisenatid-behandlede patienter (forekomst på 0,2% eller 16 tilfælde pr. 10000 patientår) end placebo-behandlet patient (forekomst på 0,1% eller 7 tilfælde pr. 10000 patientår).
Allergiske reaktioner (såsom anafylaktisk reaktion angioødem og urticaria), der blev bedømt som muligvis relateret til undersøgelsesmedicinen, blev observeret hyppigere hos lixisenatid-behandlede patienter (0,4%) end placebo-behandlede patienter (0,2%) [se se Advarsler og forholdsregler ].
Insulin glargine
Alvorlig livstruende generaliseret allergi inklusive anafylaksisk generaliserede hudreaktioner angioedema bronchospasme hypotension og chok kan forekomme med ethvert insulin inklusive Soliqua 100/33 og kan være livstruende.
Akut galdeblæresygdom
I et hjerte-kar-resultater forekom forsøg cholelithiasis hos 0,4% af lixisenatid-behandlede patienter mod 0,2% i placebo-behandlede patienter og akutte cholecystitis hos 0,3% af lixisenatidbehandlede patienter mod 0,2% i placebo-behandlingspatienter.
Indsprøjtning-Site Reactions
Som med enhver insulin- eller GLP-1-receptoragonist-kan indeholde produktpatienter, der tager Soliqua 100/33, opleve reaktion på injektionsstedet, herunder injektionsstedets hæmatoma-blødning erythema-knuder, der hæver misfarvningspruritus-varme og injektionssteder. I det kliniske program var andelen af reaktionerne på injektionsstedet, der forekommer hos patienter behandlet med Soliqua 100/33, 1,7%.
Insulininitiering og intensivering af glukosekontrol
Intensivering eller hurtig forbedring af glukosekontrol er blevet forbundet med en forbigående reversibel oftalmologisk brydningsforstyrrelse forværring af diabetisk retinopati og akut smertefuld perifer neuropati. Imidlertid reducerer langvarig glykæmisk kontrol risikoen for diabetisk retinopati og neuropati.
Perifert ødem
Nogle patienter, der tager insulin glargine en komponent i Soliqua 100/33, har oplevet natriumretention og ødemer, især hvis tidligere dårlig metabolisk kontrol forbedres ved intensiveret insulinbehandling.
Vægtøgning
Vægtøgning kan forekomme med insulinholdige produkter, herunder Soliqua 100/33 og er blevet tilskrevet de anabolske virkninger af insulin.
Immunogenicitet
12 eller 123
Som med alle terapeutiske proteiner er der potentiale for immunogenicitet. Påvisningen af antistofdannelse er meget afhængig af følsomheden og specificiteten af assayet. Derudover kan den observerede forekomst af antistof (inklusive neutraliserende antistof) positivitet i et assay påvirkes af adskillige faktorer, herunder assaymetodologi Prøvehåndteringstidspunkt for prøveopsamling Samtidig medicin og underliggende sygdom. Af disse grunde sammenligning af forekomsten af antistoffer med Soliqua 100/33 i undersøgelserne beskrevet nedenfor med forekomsten af antistoffer i andre undersøgelser eller til andre produkter kan være vildledende.
Efter 30 ugers behandling med Soliqua 100/33 i to fase 3-forsøg var forekomsten af dannelse af anti-insulin glargine antistoffer 21,0% og 26,2%. Hos ca. 93% af patienterne viste anti-insulin-glargine-antistoffer krydsreaktivitet over for humant insulin. Forekomsten af dannelse af anti-alliesenatidantistoffer var ca. 43%.
Lixisenatid
I puljen af 9 placebokontrollerede undersøgelser udsatte 70% af patienterne udsat for lixisenatid positivt for anti-alliesenatidantistoffer under forsøgene. I undergruppen af patienter (2,4%) med de højeste antistofkoncentrationer (> 100 nmol/L) blev der observeret en svækket glykæmisk respons. En højere forekomst af allergiske reaktioner og reaktioner på injektionsstedet forekom hos antistofpositive patienter [se Advarsler og forholdsregler ].
Anti-alliesenatid-antistofkarakteriseringsundersøgelser har vist potentialet for udvikling af antistoffer, der er tværreaktivt med endogen GLP-1 og glucagon, men deres forekomst er ikke fuldstændigt bestemt, og den kliniske betydning af disse antistoffer er ikke i øjeblikket kendt.
Ingen oplysninger om tilstedeværelsen af neutraliserende antistoffer er i øjeblikket tilgængelige.
Oplevelse af postmarketing
Følgende yderligere bivirkninger er blevet identificeret under brug af postgodkendelsen. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt at pålideligt estimere deres frekvens eller etablere et årsagsforhold til eksponering for lægemidler.
Nyre: Akut nyreskade
Hud: Lokaliseret kutan amyloidose på injektionsstedet er forekommet med insuliner. Hyperglykæmi er rapporteret med gentagne insulininjektioner i områder med lokaliseret kutan amyloidose; Hypoglykæmi er rapporteret med en pludselig ændring af et upåvirket injektionssted.
Hepatobiliary: cholecystitis cholelithiasis kræver kolecystektomi
Gastrointestinal: ileus
Nervesystem : dysgeusia
Lunge : Pulmonal aspiration er forekommet hos patienter, der modtager GLP-1-receptoragonister, der gennemgår valgfrie operationer eller procedurer, der kræver generel anæstesi eller dyb sedation.
Lægemiddelinteraktioner for Soliqua Indsprøjtning
Medicin, der kan påvirke glukosemetabolisme
Et antal medicin påvirker glukosemetabolismen og kan kræve dosisjustering af Soliqua 100/33 og især tæt overvågning.
| Medicin, der kan øge risikoen for hypoglykæmi | |
| Medicin: | Antidiabetiske midler ACE -hæmmere angiotensin II -receptorblokeringsmidler Disopyramid fibrater fluoxetinmonoaminoxidaseinhibitorer pentoxifylline pramlintid salicylater somatostatinanaloger (f.eks. Octreotid) og sulfonamid -antibiotika. |
| Intervention: | Doseringsreduktioner og øget hyppighed af glukoseovervågning kan være påkrævet, når Soliqua 100/33 samtidig administreres med disse lægemidler. |
| Lægemidler, der kan reducere blodsukkeret sænkende virkning af Soliqua 100/33 | |
| Medicin: | Atypiske antipsykotika (f.eks. Olanzapin og clozapin) kortikosteroider Danazol -diuretika østrogener glucagon isoniazid niacin orale præventionsfenothiaziner progestogener (f.eks. I orale prævention) proteaseinhibitorer somatropin sympatometiske agents (al albuterol epinepinephrinepressiver) Protease -inhibitorer somatropin sympati sympatometiske agententer (albuterol albuterol al albuterolenpinepinpin) og skjoldbruskkirtelhormoner. |
| Intervention: | Dosis øges og øget hyppighed af glukoseovervågning kan være påkrævet, når Soliqua 100/33 samtidig administreres med disse lægemidler. |
| Lægemidler, der kan øge eller mindske blodglukose -sænkningseffekten af Soliqua 100/33 | |
| Medicin: | Alkohol betablokkere klonidin og lithiumsalte. Pentamidin kan forårsage hypoglykæmi, som undertiden kan følges af hyperglykæmi. |
| Intervention: | Dosisjustering og øget hyppighed af glukoseovervågning kan være påkrævet, når Soliqua 100/33 samtidig administreres med disse lægemidler. |
| Lægemidler, der kan stumpe tegn og symptomer på hypoglykæmi | |
| Medicin: | Betablokkere klonidin guanethidin og reserpin. |
| Intervention: | Forøget hyppighed af glukoseovervågning kan være påkrævet, når Soliqua 100/33 samtidig administreres med disse lægemidler. |
Effekter af forsinket gastrisk tømning på orale medicin
Lixisenatid-containing products including 12 eller 123 delay gastric emptying which may reduce the rate of absorption of orally administered medications. Use caution when coadministering oral medications that have a narrow therapeutic ratio or that require careful clinical monitoring. These medications should be adequately monitored when concomitantly administered with lixisenatide. If such medications are to be administered with food patients should be advised to take them with a meal or snack when lixisenatide is not administered.
- Antibiotika acetaminophen eller andre medicin, der er særligt afhængige af tærskelkoncentrationer for effektivitet, eller som en forsinkelse i virkning er uønsket, skal administreres mindst 1 time før Soliqua 100/33 -injektion [se Klinisk farmakologi ].
- Orale prævention skal tages mindst 1 time før Soliqua 100/33 administration eller 11 timer efter [se Klinisk farmakologi ].
Advarsler om Soliqua -injektion
Inkluderet som en del af FORHOLDSREGLER afsnit.
Forholdsregler for Soliqua -injektion
Anafylaksi og alvorlige overfølsomhedsreaktioner
I kliniske forsøg med lixisenatid har der været tilfælde af anafylaksi (frekvens på 0,1% eller 10 tilfælde pr. 10000 patientår) og andre alvorlige overfølsomhedsreaktioner inklusive angioødem. Alvorlige livstruende generaliserede allergiske reaktioner inklusive anafylaksisk generaliserede hudreaktioner angioødem bronchospasme Hypotension og stød kan forekomme med insuliner inklusive insulin glargine. Der har været efter markedsføringsrapporter om alvorlige overfølsomhedsreaktioner, herunder anafylaktiske reaktioner og angioødem hos patienter behandlet med Soliqua 100/33 [se Bivirkninger ].
Informere og overvåge patienter nøje med en historie med anafylaksi eller angioødem med en anden GLP-1-receptoragonist for allergiske reaktioner, fordi det er ukendt, om sådanne patienter vil være disponeret for anafylaksi med Soliqua 100/33. Soliqua 100/33 er kontraindiceret hos patienter med kendt alvorlig overfølsomhed over for lixisenatid eller insulin glargine [se Kontraindikationer ]. If a hypersensitivity reaction occurs the patient should discontinue 12 eller 123 og promptly seek medical attention.
Pancreatitis
Akut pancreatitis inklusive dødelig og ikke-dødelig hæmoragisk eller nekrotiserende pancreatitis er rapporteret efter markedsføring hos patienter behandlet med GLP-1-receptoragonister. I kliniske forsøg med lixisenatid var der 21 tilfælde af pancreatitis blandt lixisenatid-behandlede patienter og 14 tilfælde i komparatorbehandlede patienter (forekomst af 21 mod 17 pr. 10000 patientår). Lixisenatid -tilfælde blev rapporteret som akut pancreatitis (n = 3) pancreatitis (n = 12) kronisk pancreatitis (n = 5) og ødematøs pancreatitis (n = 1). Nogle patienter havde risikofaktorer for pancreatitis, såsom en historie med cholelithiasis eller alkoholmisbrug.
Efter påbegyndelse af Soliqua 100/33 observerer de patienter omhyggeligt for tegn og symptomer på pancreatitis (inklusive vedvarende alvorlige mavesmerter, der undertiden stråler bagpå, og som måske eller måske ikke ledsages af opkast). Hvis pancreatitis straks mistænkes, afbryder Soliqua 100/33 og initierer passende styring. Hvis pancreatitis bekræftes, anbefales genstart af Soliqua 100/33 ikke. Overvej andre antidiabetiske terapier end Soliqua 100/33 hos patienter med en historie med pancreatitis.
Del aldrig en Soliqua 100/33 -forudfyldt pen mellem patienter
12 eller 123 prefilled pens must never be shared between patients even if the needle is changed. Sharing of the pen poses a risk for transmission of blood-borne pathogens.
Hyperglykæmi eller hypoglykæmi med ændringer i insulinregime
Ændringer i insulinregime (f.eks. Injektionssted for insulinstyrke -type injektionssted eller administrationsmetode) kan påvirke glykæmisk kontrol og disponere for Hypoglykæmi [se Advarsler og forholdsregler ] eller hyperglykæmi. Gentagne insulininjektioner i områder med lipodystrofi eller lokaliseret kutan amyloidose er rapporteret at resultere i hyperglykæmi; Og en pludselig ændring i injektionsstedet (til upåvirket område) er rapporteret at resultere i hypoglykæmi [se Bivirkninger ].
Foretag ændringer i en patients insulinregime under tæt medicinsk tilsyn med øget hyppighed af blodsukkerovervågning. Rådgiv patienter, der gentagne gange har injiceret i områder med lipodystrofi eller lokaliseret kutan amyloidose for at ændre injektionsstedet til upåvirkede områder og nøje overvåge for hypoglykæmi. Justeringer i samtidig oral antidiabetisk behandling kan være nødvendig. Ved konvertering fra basal insulinbehandling eller en GLP-1-receptoragonist til Soliqua 100/33 følg doseringsanbefalinger [se Dosering og administration ].
Overdosis på grund af medicinfejl
12 eller 123 contains two drugs: insulin glargine og lixisenatid. Administration of more than 60 enheder of 12 eller 123 daily can result in overdose of the lixisenatide component. Gør ikke exceed the 20-mcg maximum recommended dose of lixisenatide or use with other GlucagonÂlike peptide-1 receptor agonists.
Tilfældige blandinger mellem insulinprodukter er rapporteret. For at undgå medicinfejl mellem Soliqua 100/33 og andre insuliner instruerer patienter om altid at kontrollere insulinetiketten før hver injektion.
Hypoglykæmi
Hypoglykæmi is the most common adverse reaction associated with insulin-containing products including 12 eller 123 [se Bivirkninger ]. Severe Hypoglykæmi can cause seizures may be life-threatening or cause death. Hypoglykæmi can impair concentration ability og reaction time; this may place an individual og others at risk in situations where these abilities are important (e.g. driving or operating other machinery). 12 eller 123 (an insulin-containing product) or any insulin should not be used during episodes of Hypoglykæmi [se Kontraindikationer ].
Hypoglykæmi can happen suddenly og symptoms may differ in each individual og change over time in the same individual. Symptomatic awareness of Hypoglykæmi may be less pronounced in patients with longstoging diabetes in patients with diabetic nerve disease in patients using medications that block the sympathetic nervous system (e.g. beta-blockers) [se Lægemiddelinteraktioner ] eller hos patienter, der oplever tilbagevendende hypoglykæmi.
Risikofaktorer for hypoglykæmi
Risikoen for hypoglykæmi øges generelt med intensiteten af glykæmisk kontrol. Risikoen for hypoglykæmi efter en injektion er relateret til virkningen af insulinets varighed og generelt er højest, når glukose -sænkningseffekten af insulinet er maksimalt. Som med alle insulinholdige præparater kan glukose sænkende effekt tidsforløbet for Soliqua 100/33 variere i forskellige individer eller på forskellige tidspunkter i det samme individ og afhænger af mange tilstande, herunder injektionsområdet såvel som blodforsyning og temperatur [se Klinisk farmakologi ].
Andre faktorer, der kan øge risikoen for hypoglykæmi, inkluderer ændringer i måltidsmønster (f.eks. Makronæringsstofindhold eller timing af måltider) ændringer i niveauet for fysisk aktivitet eller ændringer i coadministreret medicin [se Lægemiddelinteraktioner ]. Patients with renal or hepatic impairment may be at higher risk of Hypoglykæmi [se Brug i specifikke populationer ].
Strategier for risikobegrænsning for hypoglykæmi
Patienter og plejere skal uddannes til at genkende og håndtere hypoglykæmi. Selvovervågning af blodsukker spiller en væsentlig rolle i forebyggelse og håndtering af hypoglykæmi. Hos patienter med højere risiko for hypoglykæmi og patienter, der har reduceret symptomatisk bevidsthed om hypoglykæmi, anbefales øget hyppighed af blodsukkerovervågning.
Den langtidsvirkende virkning af insulin-glargin kan forsinke bedring fra hypoglykæmi.
Akut nyreskade
Akut nyreskade og forværring af Kronisk nyresvigt hvilket undertiden kan kræve hæmodialyse er rapporteret efter markedsføring hos patienter behandlet med Soliqua 100/33. Nogle af disse begivenheder blev rapporteret hos patienter uden kendt underliggende nyresygdom. Et flertal af de rapporterede begivenheder forekom hos patienter, der havde oplevet kvalme til at opkaste diarré eller dehydrering.
Overvåg nyrefunktion ved initiering eller eskalerende doser af Soliqua 100/33 hos patienter med nedsat nyrefunktion og hos patienter, der rapporterer alvorlige gastrointestinale reaktioner. Rådgiv patienter om den potentielle risiko for dehydrering på grund af gastrointestinale bivirkninger og tage forholdsregler for at undgå væskeudtømning. Soliqua 100/33 anbefales ikke hos patienter med nyresygdom i slutstadiet [se Brug i specifikke populationer ].
Immunogenicitet
Patienter kan udvikle antistoffer mod insulin og lixisenatid efter behandling. En samlet analyse af undersøgelser af lixisenatid-behandlede patienter viste, at 70% var antistofpositive i uge 24. I undergruppen af patienter (2,4%) med de højeste antistofkoncentrationer (> 100 nmol/L) blev der observeret en svækket glykæmisk respons. En højere forekomst af allergiske reaktioner og reaktioner på injektionsstedet forekom hos antistofpositive patienter [se Advarsler og forholdsregler Bivirkninger ].
Hvis der er forværring af glykæmisk kontrol eller manglende opnåelse af målrettet glykæmisk kontrol, skal der overvejes signifikante reaktioner på injektionsstedet eller allergiske reaktioner, som alternative antidiabetiske terapi skal overvejes.
Hypokalæmi
Alle insulinholdige produkter inklusive Soliqua 100/33 forårsager et skift i kalium fra det ekstracellulære til det intracellulære rum, der muligvis fører til hypokalæmi. Ubehandlet hypokalæmi kan forårsage respiratorisk lammelse af ventrikulær arytmi og død. Overvåg kaliumniveauer hos patienter, der er i fare for hypokalæmi, hvis indikeret (f.eks. Patienter, der bruger kaliumsænkende medicin, patienter, der tager medicin følsomme over for serumkaliumkoncentrationer).
Fluidretention og hjertesvigt med samtidig brug af PPAR-gamma-agonister
Thiazoidinediones (TZDS), som er peroxisomproliferator-aktiveret receptor (PPAR) -gamma-agonister, kan forårsage dosisrelateret væskeopbevaring, især når de bruges i kombination med insulinholdige produkter inklusive Soliqua 100/33. Væskeopbevaring kan føre til eller forværre hjertesvigt . Patienter behandlet med Soliqua 100/33 og en PPAR-gamma-agonist skal observeres for tegn og symptomer på hjertesvigt. Hvis hjertesvigt udvikler, skal det styres i henhold til de nuværende standarder for pleje og seponering eller dosisreduktion af PPAR-gamma-agonisten skal overvejes.
Akut galdeblæresygdom
Der er rapporteret om akutte begivenheder med galdeblæresygdom, såsom cholelithiasis eller cholecystitis i GLP-1-receptoragonistforsøg og postmarked. I et hjerte-kar-resultater forekom forsøg cholelithiasis hos 0,4% af lixisenatid-behandlede patienter mod 0,2% i placebo-behandlede patienter og akutte cholecystitis hos 0,3% af lixisenatidbehandlede patienter mod 0,2% i placebo-behandlingspatienter. Hvis der er mistanke om cholelithiasis, er galdeblærestudier og passende klinisk opfølgning indikeret.
Lunge Aspiration During General Anesthesia or Deep Sedation
12 eller 123 delays gastric emptying [se Klinisk farmakologi (12.1)]. There have been rare postmarketing reports of pulmonary aspiration in patients receiving GLP-1 receptor agonists undergoing elective surgeries or procedures requiring general anesthesia or deep sedation who had residual gastric contents despite reported adherence to preoperative fasting recommendations.
Tilgængelige data er utilstrækkelige til at informere henstillinger til at afbøde risikoen for lungeaspiration under generel anæstesi eller dyb sedation hos patienter, der tager Soliqua 100/33, herunder om ændring af præoperative fasteanbefalinger eller midlertidigt at afbryde Soliqua 100/33 kunne reducere forekomsten af tilbageholdte gastriske indhold. Instruer patienter om at informere sundhedsudbydere inden planlagte operationer eller procedurer, hvis de tager Soliqua 100/33.
Oplysninger om patientrådgivning
Rådgiv patienten om at læse den FDA-godkendte patientmærkning ( Medicin vejledning og Instructions for Use ).
Overfølsomhedsreaktioner
Informer patienter om, at alvorlige overfølsomhedsreaktioner inklusive anafylaksi er rapporteret med Soliqua 100/33. Hvis der forekommer symptomer på overfølsomhedsreaktioner, instruerer patienter om at stoppe med at tage Soliqua 100/33 og søge medicinsk rådgivning [se Advarsler og forholdsregler ].
Risiko for pancreatitis
Informer patienter om, at vedvarende alvorlige mavesmerter, der kan udstråle bagpå, og som måske eller måske ikke ledsages af opkast, er det kendetegnende symptom på akut pancreatitis. Instruer patienter om straks at afbryde Soliqua 100/33 og kontakte deres læge, hvis vedvarende alvorlige mavesmerter forekommer [se Advarsler og forholdsregler ].
Del aldrig en Soliqua 100/33 pen
Rådgiv patienter om, at de aldrig må dele en Soliqua 100/33, præfyldt pen med en anden person, selvom nålen ændres, fordi det at gøre det bærer en risiko for transmission af blodbårne patogener [se Advarsler og forholdsregler ].
Hyperglykæmi eller hypoglykæmi
Informer patienter om, at hypoglykæmi er den mest almindelige bivirkning med insulinholdige produkter. Informer patienter om symptomerne på hypoglykæmi. Informer patienter om, at evnen til at koncentrere sig og reagere kan være nedsat som et resultat af hypoglykæmi [se Advarsler og forholdsregler ]. This may present a risk in situations where these abilities are especially important such as driving or operating other machinery. Advise patients who have frequent Hypoglykæmi or reduced or absent warning signs of Hypoglykæmi to use caution when driving or operating machinery.
Rådgive patienter, der ændrer sig i insulinregime, kan disponere for hyperglykæmi eller hypoglykæmi, og at ændringer i insulinregime skal foretages under tæt medicinsk tilsyn [se Advarsler og forholdsregler ].
Dehydrering og nyresvigt
Rådgiv patienter behandlet med Soliqua 100/33 om den potentielle risiko for dehydrering på grund af gastrointestinale bivirkninger og for at tage forholdsregler for at undgå væskeudtømning. Informer patienter om den potentielle risiko for forværring af nyrefunktionen, som i nogle tilfælde kan kræve dialyse [se Advarsler og forholdsregler ].
Overdosis på grund af medicinfejl
Informer patienter om, at Soliqua 100/33 indeholder to lægemidler: insulin glargine og lixisenatid. Tilfældige blandinger mellem insulinprodukter er rapporteret. For at undgå medicinfejl mellem Soliqua 100/33 og andre insulinprodukter instruerer patienter til altid at kontrollere etiketten før hver injektion. Rådgive patienter om, at administrationen af mere end 60 enheder Soliqua 100/33 dagligt kan resultere i overdosis af lixisenatid -komponenten. Instruer patienter om ikke at administrere samtidigt med andre glukagonlignende peptid-1-receptoragonister [se Advarsler og forholdsregler ].
Akut galdeblæresygdom
Informer patienter om den potentielle risiko for cholelithiasis eller cholecystitis. Instruer patienter om at kontakte deres læge, hvis cholelithiasis eller cholecystitis er mistænkt for passende klinisk opfølgning [se Advarsler og forholdsregler ].
Lunge Aspiration During General Anesthesia or Deep Sedation
Informer patienter om, at Soliqua 100/33 kan få deres mave til at tømme langsommere, hvilket kan føre til komplikationer med anæstesi eller dyb sedation under planlagte operationer eller procedurer. Instruer patienter om at informere sundhedsudbydere inden planlagte operationer eller procedurer, hvis de tager Soliqua 100/33 [se Advarsler og forholdsregler ].
Brug under graviditet
Rådgive patienter om at informere deres læger, hvis de er gravide eller har til hensigt at blive gravide [se Brug i specifikke populationer ].
Ikke -klinisk toksikologi
Karcinogenese mutagenese nedskrivning af fertilitet
12 eller 123
Der er ikke udført nogen dyreforsøg med kombinationen af insulin -glargine og lixisenatid for at evaluere carcinogenese -mutagenese eller forringelse af fertiliteten.
Insulin glargine
Hos mus og rotter blev der udført to-årige carcinogenicitetsundersøgelser med insulin-glargin i doser op til 0,455 mg/kg, hvilket var til rotten ca. 2 gange og for musen ca. 1 gange den anbefalede humane subkutane høje dosis på 60 enheder/dag (0,0364 mg/kg/dag) baseret på MG/m². Resultaterne i hunmus var ikke afgørende på grund af overdreven dødelighed i alle dosisgrupper under undersøgelsen. Histiocytomer blev fundet på injektionssteder hos hanrotter (statistisk signifikante) og hanmus (ikke statistisk signifikante) i syrkøretøj indeholdende grupper. Disse tumorer blev ikke fundet hos kvindelige dyr i saltvandskontrol eller insulin -komparatorgrupper ved anvendelse af et andet køretøj. Relevansen af disse fund for mennesker er ukendt.
Insulin glargine was not mutagenic in tests for detection of gene mutations in bacteria og mammalian cells (Ames-og HGPRT-test) og in tests for detection of chromosomal aberrations (cytogenetics in vitro in V79 cells og in vivo in Chinese hamsters).
In a combined fertility and prenatal and postnatal study with insulin glargine in male and female rats at subcutaneous doses up to 0.36 mg/kg/day which was approximately 2-times the recommended human subcutaneous maximum dose of 60 units/day (0.0364 mg/kg/day) based on mg/m² maternal toxicity due to dose-dependent hypoglycemia including some Dødsfald blev observeret. Derfor forekom en reduktion af opdrætningshastigheden kun i gruppen med høj dosis.
Lixisenatid
Karcinogenicitetsundersøgelser af 2-årige varigheder blev udført i CD-1-mus og Sprague-Dawley-rotter med to gange daglige subkutane doser på 40 200 eller 1000 mcg/kg. En statistisk signifikant stigning i skjoldbruskkirtel-C-celle-adenomer blev observeret hos mænd ved 2000 mcg/kg/dag, hvilket resulterede i eksponeringer, der er> 180 gange den menneskelige eksponering opnået ved 20 mcg/dag baseret på plasma AUC.
Statistisk signifikante stigninger i skjoldbruskkirtel-C-celle-adenomer blev set i alle doser i rotter, hvilket resulterede i systemiske eksponeringer, der er ≥15 gange den menneskelige eksponering opnået ved 20 mcg/dag baseret på plasma AUC. En numerisk stigning i skjoldbruskkirtel-c-cellecarcinomer blev observeret hos rotter ved ≥400 mcg/kg/dag, hvilket resulterede i systemiske eksponeringer, der er ≥56 gange den menneskelige eksponering opnået ved 20 mcg/dag baseret på plasma AUC.
Mutagenese
Lixisenatid was not mutagenic or clastogenic in a stogard battery of genotoxicity tests (bacterial mutagenicity [Ames] human lymphocyte chromosome aberration mouse bone marrow micronucleus).
Værdiforringelse af fertiliteten
Undersøgelser, hvor mandlige og kvindelige rotter modtog to gange daglige subkutane doser lixisenatid på 2 29 eller 414 mcg/kg før parring gennem drægtighedsdag 6, indikerede ikke nogen bivirkninger på mandlig eller kvindelig fertilitet i rotter op til den højeste dosis, der blev testet 414 mcg/kg eller ca. 400âtimider den kliniske systemiske eksponering ved 20 mcg/dag baseret på MCG/m².
Brug i specifikke populationer
Graviditet
Risikooversigt
Baseret på dyreproduktionsundersøgelser kan der være risici for fosteret fra eksponering for lixisenatid en komponent i Soliqua 100/33 under graviditet. Soliqua 100/33 bør kun bruges under graviditet, hvis den potentielle fordel berettiger den potentielle risiko for fosteret.
De begrænsede tilgængelige data med Soliqua 100/33 og lixisenatid hos gravide kvinder er ikke tilstrækkelig til at informere en medikamentassocieret risiko for store fødselsdefekter og spontanabort. Offentliggjorte undersøgelser med insulin -glargine -brug under graviditet har ikke rapporteret om en klar tilknytning til insulin -glargine og major fødselsdefekt eller spontanabortrisiko [se Data ]. There are risks to the mother og fetus associated with poorly controlled diabetes in pregnancy [se Kliniske overvejelser ].
Lixisenatid administered to pregnant rats og rabbits during organogenesis was associated with visceral closure og skeletal defects at systemic exposures that decreased maternal food intake og vægtøgning during gestation og that are 1-time og 6-times higher than the 20 mcg/day highest clinical dose respectively based on plasma AUC [se Data ].
Den estimerede baggrundsrisiko for større fødselsdefekter er 6% -10% hos kvinder med pregestationel diabetes med en HBA1C> 7 og er rapporteret at være så høj som 20% -25% hos kvinder med en HBA1C> 10. Den estimerede baggrundsrisiko for spontanabort for den angivne befolkning er ukendt. I den amerikanske generelle befolkning er den estimerede baggrundsrisiko for store fødselsdefekter og spontanabort i klinisk anerkendte graviditeter henholdsvis 2% -4% og 15% -20%.
Kliniske overvejelser
Sygdomsassocieret moderlig og/eller embryo/føtal risiko
Dårligt kontrolleret diabetes i graviditeten øger moderens risiko for diabetisk ketoacidosis præâeklampsi spontane aborter for tidlige leverings- og leveringskomplikationer. Dårligt kontrolleret diabetes øger føtalens risiko for større fødselsdefekter stadig fødsel og makrosomi -relateret sygelighed.
Data
Menneskelige data
Insulin glargine
Publicerede data rapporterer ikke en klar tilknytning til insulin glargine og større fødselsdefekter spontanabort eller ugunstige moderlige eller føtale resultater, når insulin glargine bruges under graviditet. Imidlertid kan disse undersøgelser ikke bestemt fastlægge fraværet af nogen risiko på grund af metodologiske begrænsninger, herunder lille prøvestørrelse og nogle manglende komparatorgrupper.
Dyredata
Dyreproduktionsundersøgelser blev ikke udført med de kombinerede produkter i Soliqua 100/33. Følgende data er baseret på undersøgelser udført med de individuelle komponenter i Soliqua 100/33.
Lixisenatid
Hos gravide rotter, der modtog to gange daglige subkutane doser på 2,5 35 eller 500 mcg/kg under organogenese (drægtighedsdag 6 til 17), var fostre til stede med viscerale lukningsdefekter (f.eks. Mikrophthalmia bilateral anophthalmia -membranisk brok) og stuntet vækst. Nedsat ossifikation forbundet med skeletmisdannelser (f.eks. Bøjede lemmer scapula-clavicle og bækken) blev observeret ved ≥2,5 mcg/kg/dosis, hvilket resulterede i systemisk eksponering, der er 1-gang den 20 mcg/dag klinisk dosis baseret på plasma AUC. Fald i moderlig kropsvægt madforbrug og motorisk aktivitet blev observeret samtidig med de ugunstige føtal fund, der forvirrer fortolkningen af relevansen af disse misdannelser til den menneskelige risikovurdering. Placentaloverførsel af lixisenatid til udvikling af rottefostre er lav med et koncentrationsforhold i føtal/moderlig plasma på 0,1%.
Hos gravide kaniner, der modtog to gange daglige subkutane doser på 2,5 25 250 mcg/kg under organogenese (drægtighedsdag 6 til 18), var fostre til stede med flere viscerale og skeletmalformationer inklusive lukningsfejl ved ≥5 mcg/kg/dag eller systemiske eksponeringer, der er 6 -tider de 20 mcg/dags højeste kliniske dosis baseret på plasma AUC. Fald i mødre kropsvægt madforbrug og motorisk aktivitet blev observeret samtidig med de føtal fund, der forvirrer fortolkningen af relevansen af disse misdannelser til den menneskelige risikovurdering. Placentaloverførsel af lixisenatid til udvikling af kaninfostre er lav med et koncentrationsforhold i føtal/moderlig plasma på ≤0,3%. I en anden undersøgelse i gravide kaniner blev der ikke observeret nogen lægemiddelrelaterede misdannelser fra to gange daglige subkutane doser på 0,15 1,0 og 2,5 mcg/kg indgivet under organogenese, hvilket resulterede i systemiske eksponeringer op til 9 gange den kliniske eksponering ved 20 mcg/dag baseret på plasma AUC.
Hos gravide rotter, der blev givet to gange daglige subkutane doser på 2 20 eller 200 mcg/kg fra drægtighedsdag 6 gennem amning, blev fald i moderlig kropsvægt madforbrug og motorisk aktivitet observeret i alle doser. Skeletalmisdannelser og forøget hvalpedødelighed blev observeret ved 400 mcg/kg/dag, hvilket er cirka 200 gange de 20 mcg/dags kliniske dosis baseret på MCG/m².
Insulin glargine
Underkutan reproduktions- og teratologiundersøgelser er blevet udført med insulin -glargin og regelmæssig humant insulin hos rotter og Himalaya -kaniner. Insulin-glargin blev givet til kvindelige rotter før parring under parring og under hele graviditeten i doser op til 0,36 mg/kg/dag, hvilket er cirka 2 gange den anbefalede humane subkutane høje dosis på 60 enheder/dag (0,0364 mg/kg/dag) baseret på mg/m². Hos kaniner doser op til 0,072 mg/kg/dag, hvilket er ca. 1âtider, blev det maksimale anbefalede humane subkutane dosis på 60 enheder/dag (0,0364 mg/kg/dag) baseret på mg/m² administreret under organogenese. Virkningerne af insulin -glargin adskiller sig generelt ikke fra dem, der blev observeret med almindeligt humant insulin hos rotter eller kaniner. Men hos kaniner udviste fem fostre fra to kuld i højdosis-gruppen udvidelse af cerebrale ventrikler. Fertilitet og tidlig embryonal udvikling syntes normal.
Amning
Risikooversigt
Der er ingen oplysninger om tilstedeværelsen af lixisenatid og insulin glargine i human mælk virkningerne på det ammede spædbarn eller virkningerne på mælkeproduktionen. Endogent insulin er til stede i human mælk. Lixisenatid er til stede i rottemælk [se Data ].
De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med mors kliniske behov for Soliqua 100/33 og eventuelle bivirkninger på det ammede barn fra Soliqua 100/33 eller fra den underliggende moderlige tilstand.
Data
Lixisenatid
En undersøgelse i ammende rotter viste lav (9,4%) overførsel af lixisenatid og dets metabolitter til mælk og ubetydelige (0,01%) niveauer af uændret lixisenatidprotein i gastrisk indhold af fravænning af afkom.
Pædiatrisk brug
Soliqua 100/33 sikkerhed og effektivitet er ikke blevet fastlagt hos pædiatriske patienter.
Geriatrisk brug
Af det samlede antal forsøgspersoner (n = 834) i kontrollerede kliniske undersøgelser af patienter med type 2 diabetes der blev behandlet med Soliqua 100/33 25,2% (n = 210) var ≥65 år og 4% (n = 33) var ≥75 år. Der blev ikke observeret nogen samlede forskelle i effektivitet og sikkerhed i undergruppeanalyserne i aldersgrupperne.
Ikke desto mindre skal der udvises forsigtighed, når Soliqua 100/33 administreres til geriatriske patienter. Hos ældre patienter med diabetes bør den indledende doseringsdosisforøgelse og vedligeholdelsesdosering være konservativ for at undgå hypoglykæmiske reaktioner. Hypoglykæmi kan være vanskelig at genkende hos ældre.
Nedskærmning af nyren
Hyppig glukoseovervågning og dosisjustering kan være nødvendig for Soliqua 100/33 hos patienter med nedsat nyrefunktion [se Advarsler og forholdsregler ].
Insulin glargine
Nogle undersøgelser med humant insulin har vist øgede cirkulerende niveauer af insulin hos patienter med nyresvigt.
Lixisenatid
Hos patienter med mild og moderat nedsat nyrefunktion kræves der ingen dosisjustering, men tæt overvågning for lixisenatidrelaterede bivirkninger og til ændringer i nyrefunktion anbefales på grund af højere forekomster af hypoglykæmi kvalme og opkast, der blev observeret hos disse patienter. Forøgede gastrointestinale bivirkninger kan føre til dehydrering og akut nyresvigt og worsening of chronic failure in these patients.
Klinisk erfaring hos patienter med alvorlig nedsat nyrefunktion er begrænset, da der kun var 5 patienter med alvorlig nedsat nyrefunktion (EGFR 15 til mindre end 30 ml/min/1,73 m²) udsat for lixisenatid i alle kontrollerede studier. Lixisenatideksponering var højere hos disse patienter [se Klinisk farmakologi ]. Patients with severe renal impairment exposed to lixisenatide should be closely monitored for occurrence of gastrointestinal adverse reactions og for changes in renal function.
Der er ingen terapeutisk oplevelse hos patienter med nyresygdom i slutstadiet (EGFR <15 mL/min/1.73 m²) og it is not recommended to use 12 eller 123 in this population.
Leverskrivning i leveren
Effekten af leverindvinding på farmakokinetikken i Soliqua 100/33 er ikke undersøgt. Hyppig glukoseovervågning og dosisjustering kan være nødvendig for Soliqua 100/33 hos patienter med nedsat leverfunktion [se Advarsler og forholdsregler ].
Patienter med gastroparese
Lixisenatid slows gastric emptying. Patients with preexisting gastroparesis were excluded from clinical trials of 12 eller 123. 12 eller 123 is not recommended in patients with severe gastroparesis.
Overdoseringsoplysninger til Soliqua -injektion
Insulin glargine
Overskydende insulinadministration kan forårsage hypoglykæmi og hypokalæmi [se Advarsler og forholdsregler ]. Mild episodes of Hypoglykæmi can usually be treated with oral kulhydrater . Justeringer i lægemiddeldoseringsmåltidsmønstre eller træning kan være nødvendige.
Mere alvorlige episoder med hypoglykæmi med koma -anfald eller neurologisk svækkelse kan behandles med intramuskulær/subkutan glukagon eller koncentreret intravenøs glukose. Efter tilsyneladende klinisk bedring fra hypoglykæmi fortsatte fortsat observation, og yderligere kulhydratindtag kan være nødvendigt for at undgå gentagelse af hypoglykæmi. Hypokalæmi skal korrigeres korrekt.
Lixisenatid
Under kliniske studier blev doser op til 30 mcg lixisenatid to gange dagligt (3 gange den daglige anbefalede dosis) administreret til type 2-diabetespatienter i en 13-ugers undersøgelse. En øget forekomst af gastrointestinale lidelser blev observeret.
I tilfælde af overdosis skal passende understøttende behandling initieres i henhold til patientens kliniske tegn og symptomer og Soliqua 100/33 -dosis skal reduceres til den foreskrevne dosis.
Kontraandikationer til Soliqua -injektion
12 eller 123 is contraindicated:
- Under episoder med hypoglykæmi [se Advarsler og forholdsregler ].
- Hos patienter med alvorlig overfølsomhed over for insulin glargine lixisenatid eller nogen af excipienserne i Soliqua 100/33. Overfølsomhedsreaktioner inklusive anafylaksi er forekommet med både lixisenatid og insulin glargine [se Advarsler og forholdsregler og Bivirkninger ].
Klinisk farmakologi for Soliqua Indsprøjtning
Handlingsmekanisme
12 eller 123
12 eller 123 is a combination of insulin glargine a basal insulin analog og lixisenatide a GLP-1 receptor agonist.
Insulin glargine
Den primære aktivitet af insulin inklusive insulin -glargin er regulering af glukosemetabolisme. Insulin og dets analoger sænker blodsukkeret ved at stimulere perifer glukoseoptagelse især ved knoglemuskler og fedt og ved at hæmme leverglukoseproduktionen. Insulin hæmmer lipolyse og proteolyse og forbedrer proteinsyntese.
Lixisenatid
Lixisenatid is a GLP-1 receptor agonist that increases glucose-dependent insulin release decreases Glucagon secretion og slows gastric emptying.
Farmakodynamik
Insulin glargine
Kombinationen af insulin -glargin og lixisenatid har ingen indflydelse på farmakodynamikken af insulin -glargin. Virkningen af kombinationen af insulin -glargin og lixisenatid på farmakodynamikken af lixisenatid er ikke undersøgt i fase 1 -undersøgelser.
Lixisenatid
I en klinisk farmakologiundersøgelse hos voksne med type 2 Diabetes mellitus Lixisenatid reducerede fastende plasmaglukose og postprandial blodglukose AUC0-300min sammenlignet med placebo (-33,8 mg/dL og -387 mg • H/DL) efter et standardiseret testmåltid. Effekten på postprandial blodsukker AUC var mest bemærkelsesværdig med det første måltid, og effekten blev dæmpet med senere måltider om dagen.
Behandling med lixisenatid 20 mcg en gang dagligt reducerede det postprandiale glukagonniveauer (AUC0-300min) sammenlignet med placebo med -15,6 H • pmol/L efter et standardiseret testmåltid hos patienter med type 2 -diabetes.
Hjertelektrofysiologi (QTC)
Ved en dosis 1,5 gange forlænger den anbefalede dosis lixisenatid ikke QTC-intervallet i noget klinisk relevant omfang.
Farmakokinetik
12 eller 123
Insulin -glargin/lixisenatidforholdet har ingen relevant indflydelse på PK for insulin glargine i Soliqua 100/33.
Sammenlignet med administration af lixisenatid alene er Cmax lavere, mens AUC generelt kan sammenlignes, når den administreres som Soliqua 100/33. Insulin -glargin/lixisenatidforholdet har ingen indflydelse på PK for lixisenatid i Soliqua 100/33. De observerede forskelle i PK for lixisenatid, når det gives som Soliqua 100/33 eller alene, anses ikke for at være klinisk relevante.
Absorption
Efter subkutan indgivelse af insulin glargine/lixisenatid -kombinationer viste insulin glargine ingen udtalt top. Eksponering for insulin -glargine varierede fra 86% til 101% sammenlignet med administration af insulin glargine alene.
Efter subkutan indgivelse af insulin glargine/lixisenatid -kombinationer var median Tmax af lixisenatid i området 2,5 til 3,0 timer. Der var et lille fald i Cmax af lixisenatid på 22% -34% sammenlignet med separat samtidig administration af insulin-glargin og lixisenatid, hvilket sandsynligvis ikke er klinisk signifikant. Der er ingen klinisk relevante forskelle i absorptionshastigheden, når lixisenatid administreres subkutant i maven lår eller arm.
Fordeling
Proteinbindingen af lixisenatid er 55%.
Metabolisme og eliminering
En metabolismestudie hos mennesker, der modtog insulin-glargine alene, indikerer, at insulin-glargine delvist metaboliseres ved carboxylterminalen i B-kæden i det subkutane depot til dannelse af to aktive metabolitter med in vitro-aktivitet svarende til den af humant insulin M1 (21Aâgly-insulin) og M2 (21A-gly-des-30b-thr-insaf). Uændret lægemiddel og disse nedbrydningsprodukter er også til stede i cirkulationen.
Lixisenatid is presumed to be eliminated through glomerular filtration og proteolytic degradation.
Efter multiple dosisadministration hos patienter med type 2-diabetes var gennemsnitlig terminal halveringstid ca. 3 timer og den gennemsnitlige tilsyneladende clearance (CL/F) ca. 35 l/h.
Særlige befolkninger
Effekter af alder kropsvægt køn og race
Insulin glargine
Effekt af aldersløb og køn på farmakokinetikken af insulin glargine er ikke blevet evalueret. I kontrollerede kliniske forsøg hos voksne med insulin -glargine (100 enheder/ml) undergruppeanalyser baseret på aldersløb og køn viste ikke forskelle i sikkerhed og effektivitet.
Lixisenatid
Alder kropsvægt køn og race blev ikke observeret at have meningsfuldt påvirke farmakokinetikken af lixisenatid i population PK -analyser.
Nedskærmning af nyren
Lixisenatid
Sammenlignet med raske forsøgspersoner (n = 4) plasma Cmax af lixisenatid blev øget med ca. 60% 42% og 83% i individer med mild (CLCR 60-89 ml/min [n = 9]) Moderat (CLCR 30-59 ml/min [n = 11]) og svær (CLCR 15-29 ml/min [n = 8]) REAL NEMMELSE. Plasma AUC blev øget med ca. 34% 69% og 124% med mild moderat og alvorlig nedsat nyrefunktion Brug i specifikke populationer ].
Lægemiddelinteraktionsundersøgelser med Soliqua 100/33
Insulin glargine og lixisenatide have no relevant potential to induce or inhibit CYP isozymes og therefore no direct drug interaction is expected.
Ud over interaktionsundersøgelserne udført med de individuelle komponenter blev der ikke udført yderligere interaktionsundersøgelser med Soliqua 100/33.
Lægemiddelinteraktionsundersøgelser med lixisenatid
Lægemiddelinteraktionsundersøgelserne fokuserede på potentialet for lixisenatid til at påvirke hastigheden og omfanget af eksponering for coadministrerede lægemidler på grund af dets kendte forsinkelseseffekt på gastrisk tømning.
Acetaminophen
Lixisenatid 10 mcg did not change the overall exposure (AUC) of acetaminophen following administration of a single dose of acetaminophen 1000 mg whether before or after lixisenatide.
Ingen effekter på acetaminophen Cmax og Tmax blev observeret, da acetaminophen blev administreret 1 time før lixisenatid. Ved administreret 1 eller 4 timer efter 10 mcg blev lixisenatid Cmax af acetaminophen reduceret med henholdsvis 29% og 31%, og median Tmax blev henholdsvis forsinket med 2,0 og 1,75 timer.
Orale prævention
Administration af en enkelt dosis af et oralt præventionsmiddelprodukt (ethinylestradiol 0,03 mg/levonorgestrel 0,15 mg) 1 time før eller 11 timer efter 10 mcg lixisenatid ændrede ikke Cmax AUC T½ og Tmax af ethinylestradiol og Levonorestrel.
Administration af den orale prævention 1 time eller 4 timer efter lixisenatid påvirkede ikke den samlede eksponering (AUC) og gennemsnitlig terminal halveringstid (T½) af ethinylestradiol og levonorgestrel. Cmax af ethinylestradiol blev imidlertid reduceret med henholdsvis 52% og 39%, og Cmax af levonorgestrel blev reduceret med henholdsvis 46% og 20%, og median Tmax blev forsinket med 1 til 3 timer.
Atorvastatin
Når lixisenatid 20 mcg og atorvastatin 40 mg blev coadministreret om morgenen i 6 dage blev eksponeringen af atorvastatin ikke påvirket, mens Cmax blev reduceret med 31%, og Tmax blev forsinket med 3,25 timer. Der blev ikke observeret nogen sådan stigning for Tmax, da atorvastatin blev administreret om aftenen og lixisenatid om morgenen, men AUC og Cmax af atorvastatin blev forøget med henholdsvis 27% og 66%.
Warfarin og andre coumarinderivater
Efter samtidig administration af warfarin 25 mg med gentagen dosering af lixisenatid 20 mcg var der ingen virkninger på AUC eller INR (internationalt normaliseret forhold), mens Cmax blev reduceret med 19%, og Tmax blev forsinket med 7 timer.
Digoxin
Efter samtidig administration af lixisenatid 20 mcg og digoxin 0,25 mg ved stabil tilstand blev AUC af digoxin ikke påvirket. Tmax af digoxin blev forsinket med 1,5 timer, og Cmax blev reduceret med 26%.
Ramipril
Efter samtidig administration af lixisenatid 20 mcg og ramipril 5 mg i 6 dage blev AUC for Ramipril forøget med 21%, mens Cmax blev reduceret med 63%. AUC og Cmax af den aktive metabolit (ramiprilat) blev ikke påvirket. Tmax af Ramipril og Ramiprilat blev forsinket med cirka 2,5 timer.
Kliniske studier
Oversigt over kliniske undersøgelser
12 eller 123 was evaluated in two rogomized clinical studies in patients with type 2 diabetes mellitus. In each of the active-controlled trials treatment with 12 eller 123 produced statistically significant improvements in HbA1c.
Klinisk undersøgelse hos patienter med type 2 -diabetes ukontrolleret på OAD -behandling
I alt 1170 patienter med type 2-diabetes blev randomiseret i en open-label 30-ugers aktivkontrolleret undersøgelse (undersøgelse A: NCT05058147) for at evaluere effektiviteten og sikkerheden af Soliqua 100/33 sammenlignet med de individuelle komponenterinsulin-glargine 100 enheder/ml og loksenatid.
Patients with type 2 diabetes treated with metformin alone or treated with metformin and a second OAD treatment that could be a sulfonylurea or a glinide or a sodium-glucose cotransporter-2 (SGLT-2) inhibitor or a dipeptidyl peptidase-4 (DPP-4) inhibitor and who were not adequately controlled with this treatment (HbA1c range 7.5% to 10% For patienter, der tidligere blev behandlet med metformin alene og 7% til 9% for patienter, der tidligere blev behandlet med metformin og en anden OAD-behandling), gik ind i en run-in-periode i 4 uger. I løbet af denne run-in-periode blev metforminbehandlingen optimeret, og alle andre OAD'er blev afbrudt. Ved afslutningen af run-in-perioden blev patienter, der forblev utilstrækkeligt kontrolleret (HBA1C mellem 7% og 10%) randomiseret til enten Soliqua 100/33 (n = 469) insulin glargine 100 enheder/ml (n = 467) eller lixisenatid (n = 234).
Population af type 2 -diabetes havde følgende egenskaber: middelalderen var 58,4 år 50,6% var mandlige 90,1% var kaukasiske 6,7% var sorte eller afroamerikanske og 19,1% var latinamerikanske. Ved screening af den gennemsnitlige varighed af diabetes var ca. 9 år, at den gennemsnitlige BMI var ca. 31,7 kg/m² og gennemsnitlig EGFR var 84,8 ml/min/1,73 m².
12 eller 123 og insulin glargine were to be titrated weekly to target a fasting plasma glucose goal of <100 mg/dL. Patients could not increase their dose by more than 4 units per week og the prespecified maximum dose of insulin glargine was limited to 60 enheder. The targeted fasting plasma glucose goal was achieved in 35% of patients in both groups at 30 weeks.
I uge 30 leverede Soliqua 100/33 statistisk signifikant forbedring i HBA1C (Pâvalue <0.0001) compared to insulin glargine 100 enheder/mL og lixisenatide-treated patients (-1.6% -1.3% og -0.9%). In a prespecified analysis of this primary endpoint the differences observed were consistent with regard to baseline OAD use (metformin alone or metformin plus second OAD).
Den gennemsnitlige forskel (95% CI) i HBA1C -reduktion mellem Soliqua 100/33 og insulin -glargin var -0,3% (-0,4 -0,2) og -0,7% (-0,8 -0,6) sammenlignet med lixisenatid.
Se tabel 5 for de andre slutpunkter i undersøgelsen. Forskellen i glukose -sænkningseffekten, der er observeret i forsøget, afspejler muligvis ikke nødvendigvis den virkning, der vil blive observeret i plejeindstillingen, hvor insulindlargindosis kan være anderledes end den, der bruges i forsøget.
Tabel 5: Resultater efter 30 uger-tilføjet til metformin-klinisk undersøgelse
| 12 eller 123 | Insulin glargine 100 enheder/mL | Lixisenatid | |
| Antal emner (randomiseret og behandlet) | 469 | 467 | 233 |
| Halc (%) | |||
| Baseline (gennemsnit; post-run-in fase) | 8.1 | 8.1 | 8.1 |
| End of Study (middelværdien) | 6.5 | 6.8 | 7.3 |
| Ls ændring fra baseline (middelværdi)* | -1.6 | -1.3 | -0.9 |
| Ls gennemsnitlig forskel vs insulin glargine [95% konfidensinterval] (p-værdi) | -0,3 [-0,4 -0,2] † (<0.0001) | - | |
| Ls gennemsnitlig forskel vs lixisenatid [95% konfidensinterval] (p-værdi) | - | - | -0.7 [-0,8 -0,6] ‡ (<0.0001) |
| Antal patienter (%) når HBA1C <7% at week 30 | 345 (74%) | 277 (59%) | 76 (33%) |
| Fastende plasmaglukose (mg/dl) | |||
| Baseline (middelværdi) | 177.9 | 175.7 | 175.8 |
| End of Study (middelværdien) | 113.9 | 117.6 | 149.0 |
| Ls ændring fra baseline (middelværdi) | -59.1 | -55.8 | -27.2 |
| * Estimeret ved hjælp af en ANCOVA med behandlingsrandomiseringsstrata og land som faste faktorer og baseline Hba1c som covariat. Seksogtyve (5,5%) patienter i Soliqua 100/33 ARM og 21 (4,5%) patienter i insulin glargine 100 enheder/ml-armen og 13 (5,6%) patienter i lixisenatidarmen var manglende HBA1C-måling i uge 30. Manglende målinger blev tildelt ved hjælp af flere imputationer med hensyn til basisværdien af emnet. † Forsøget var designet til at vise bidraget fra GLP-1-komponenten til glykæmisk sænkning og insulindlargindosis, og doseringsalgoritmen blev valgt til at isolere effekten af GLP-1-komponenten. Ved afslutningen af forsøget var doserne af insulin -glargine ækvivalente mellem behandlingsgrupper. Den gennemsnitlige endelige dosis af Soliqua 100/33 i uge 30 var 39,8 enheder (for Soliqua 100/33: 39,8 enheder Insulin glargine/13,1 mcg lixisenatid) og 40,5 enheder i insulin -glargine -behandlede patienter. Forskellen i virkning, der er observeret i forsøget, afspejler muligvis ikke nødvendigvis den virkning, der vil blive observeret i plejeindstillingen, hvor alternativ insulindlargindosis kan anvendes. ‡ Lixisenatid blev givet ved vedligeholdelsesdosis på 20 mcg. |
Figur 1: Gennemsnitlig Hba1c (%) over tid - randomiseret og behandlet befolkning
S = screening (uge 6) r = run-in (uge 1) b = baseline mi = multiple imputation.
INS/LIXI = Fast Forholdskombination INS = Insulin glargine lixi = lixisenatid
Bemærk: Handlingen omfattede alle planlagte målinger, der blev opnået under undersøgelsen, inklusive dem, der blev opnået efter imponerende eller introduktion af redningsmedicin.
30MI: Manglende HBA1C -værdier i uge 30 i hver gruppe blev beregnet ved hjælp af deres baseline HBA1C -værdier plus en fejl.
Fejlen er normalt fordelt med gennemsnitlig nul og en standardafvigelse, der er lig med den estimerede samlede standardafvigelse.
Kliniske studier In Patients With Type 2 Diabetes Uncontrolled On Basal Insulin
I alt 736 patienter med type 2-diabetes deltog i en randomiseret 30-ugers aktivkontrolleret open-label 2-behandlingsarm parallel-gruppe multicenterundersøgelse (undersøgelse B: NCT02058160) for at evaluere effektiviteten og sikkerheden af Soliqua 100/33 sammenlignet med insulinglargine 100 enheder/ml.
Patienter, der blev screenet af screenet, havde type 2-diabetes, blev behandlet med basal insulin i mindst 6 måneder, der fik en stabil daglig dosis på mellem 15 og 40 enheder alene eller kombineret med 1 eller 2 OAD'er (metforminsulfonylura-glinid SGLT-2-inhibitor eller en DPP-4-hæmmer) havde en HBA1C mellem 7,5% og 10% og en FPG mindre end eller lig til 180 MG/DL eller 200 200 MG/DL afhængigt af deres tidligere antidiabetiske behandling.
Denne type 2 -diabetespopulation havde følgende egenskaber: middelalderen var 60 år 46,7% var mandlige 91,7% var kaukasiske 5,2% var sorte eller afroamerikanske og 17,9% var spansktalende. Ved screening var den gennemsnitlige varighed af diabetes ca. 12 år, at den gennemsnitlige BMI var ca. 31 kg/m² gennemsnitlig EGFR var 80,6 ml/min/1,73 m² og 86,1% af patienterne havde en EGFR ≥60 ml/min.
Efter screening af støtteberettigede patienter (n = 1018) gik ind i en 6-ugers run-in-fase, hvor patienter forblev på eller blev skiftet til insulin glargine 100 enheder/ml, hvis de blev behandlet med en anden basal insulin og havde deres insulin glargine dosis titreret/stabiliseret, mens de fortsatte metformin â
Ved afslutningen af run-in-perioden med en HBA1C mellem 7% og 10% FPG ≤140 mg/dL og insulin glargine daglig dosis på 20 til 50 enheder (mellem 35 enheder) blev randomiseret til enten Soliqua 100/33 (n = 367) eller insulin glargine 100 enheder/ml (n = 369).
12 eller 123 og insulin glargine were to be titrated weekly to target a fasting plasma glucose goal of <100 mg/dL. The mean dose of insulin glargine at baseline was 35 enheder. The maximum dose of insulin glargine allowed in the trial was 60 enheder (insulin dose cap) in both groups. The targeted fasting plasma glucose goal was achieved in 33% of patients in both groups at 30 weeks.
I uge 30 var der en reduktion i HBA1C fra baseline på -1,1% for Soliqua 100/33 og -0,6% for insulin glargine 100 enheder/ml. Den gennemsnitlige forskel (95% CI) i HBA1C -reduktion mellem Soliqua 100/33 og insulin glargine var -0,5 [-0,6 -0,4] og statistisk signifikant. Forsøget var designet til at vise bidraget fra GLP-1-komponenten til glykæmisk sænkning, og insulindlargindosis og doseringsalgoritmen blev valgt til at isolere effekten af GLP-1-komponenten. Ved afslutningen af forsøget var doserne af insulin -glargine ækvivalente mellem behandlingsgrupper. Den gennemsnitlige endelige dosis af Soliqua 100/33 og Insulin Glargine i uge 30 var 46,7 enheder (for Soliqua 100/33: 46,7 enheder Insulin glargine/15,6 mcg lixisenatid). Forskellen i virkning, der er observeret i forsøget, afspejler muligvis ikke nødvendigvis den virkning, der vil blive observeret i plejeindstillingen, hvor alternativ insulindlargindosis kan anvendes. Se tabel 6 for de andre slutpunkter i undersøgelsen.
Tabel 6: Resultater af en 30-ugers undersøgelse hos patienter med type 2-diabetes mellitus utilstrækkeligt kontrolleret på basal insulin
| 12 eller 123 | Insulin glargine 100 enheder/mL | |
| Antal emner (randomiseret og behandlet) | 365 | 365 |
| Hba1c (%) | ||
| Baseline (gennemsnit; post-run-in fase) | 8.1 | 8.1 |
| End of Study (middelværdien) | 6.9 | 7.5 |
| Ls ændring fra baseline (middelværdi)* | -1.1 | -0.6 |
| Forskel vs insulin glargine | -0.5 | |
| [95% konfidensinterval] | [-0,6 -0,4] † | |
| Patienter [n (%)] når Hba1c <7% at week 30 ‡ | 201 (55,1%) | 108 (29,6%) |
| Fastende plasmaglukose (mg/dl) | ||
| Baseline (middelværdi) | 132.3 | 132.0 |
| End of Study (middelværdien) | 121.9 | 120.5 |
| Ls ændring fra baseline (middelværdi) | -5.7 | -7.0 |
| * Estimeret ved hjælp af en ANCOVA med behandlingsrandomiseringsstrata og land som faste faktorer og baseline Hba1c som covariat. Tyve (5,5%) patienter i Soliqua 100/33 ARM og 10 (2,7%) patienter i insulin glargine 100 enheder/ml -armen havde manglende HBA1C -måling i uge 30. Manglende målinger blev beregnet ved hjælp af flere imputationer med hensyn til basisværdien af emnet. † p<0.01; The trial was designed to show the contribution of the GLP-1 component to glucose lowering. The insulin glargine dose in this trial was capped at a maximum dose of 60 enheder og the dosing algorithm was selected to isolate the effect of the GLP-1 component. At the end of the trial the doses of insulin glargine were equivalent between treatment groups. The mean final dose of 12 eller 123 og insulin glargine at week 30 was 46.7units (for 12 eller 123: 46.7 units insulin glargine/15.6 mcg lixisenatide). The difference in effect observed in the trial may not necessarily reflect the effect that will be observed in the care setting where alternative insulin glargine dosage can be used. ‡ Patienter med manglende HBA1C-måling i uge 30 blev betragtet som ikke-responderende. |
Patientinformation til Soliqua -injektion
Soliqua® 100/33
(Så -a -a -)
(Insulin glargine og lixisenatid) injektion til subkutan brug
Hvad er de vigtigste oplysninger, jeg skal vide om Soliqua 100/33?
Del ikke din Soliqua 100/33 pen med andre mennesker, selvom nålen er blevet ændret. Du kan give andre mennesker en alvorlig infektion eller få en alvorlig infektion fra dem.
12 eller 123 can cause serious side effects including inflammation of the pancreas (Pancreatitis) hvilket kan være alvorligt og føre til død.
Før du bruger Soliqua 100/33, fortæl din sundhedsudbyder, hvis du har haft det:
- Pancreatitis
- En historie med alkoholisme
- Sten i din galdeblære (cholelithiasis)
Disse medicinske problemer kan gøre dig mere tilbøjelig til at få pancreatitis.
Stop med at tage Soliqua 100/33 og ring med din sundhedsudbyder med det samme, hvis du har smerter i dit maveområde (maven), der er alvorlig og ikke vil forsvinde. Smerten kan mærkes, der går fra din mave til din ryg. Smerten kan ske med eller uden opkast. Dette kan være symptomer på pancreatitis.
Hvad er det bedste i 100/33?
12 eller 123 is an injectable prescription medicine that contains 2 diabetes medicines insulin glargine og lixisenatid which may improve blood sugar (glucose) control in adults with type 2 diabetes when used with diet og exercise.
- 12 eller 123 has not been studied in people with a history of Pancreatitis.
- 12 eller 123 is not recommended for people who also take lixisenatide or other medicines called GLP-1 receptor agonists.
- 12 eller 123 is not for use in people with type 1 diabetes or people with diabetic ketoacidosis.
- 12 eller 123 has not been studied in people who have a stomach problem that causes slow emptying of the stomach (gastroparesis). 12 eller 123 is not for people with slow emptying of the stomach.
- 12 eller 123 has not been studied in people who also take a short-acting (progial) insulin.
Det vides ikke, om Soliqua 100/33 er sikker og effektiv hos børn.
Hvem skal ikke bruge Soliqua 100/33?
Brug ikke Soliqua 100/33, hvis du:
- har en episode af lavt blodsukker (hypoglykæmi).
- er allergiske over for insulin glargine lixisenatid eller nogen af de andre ingredienser i Soliqua 100/33. Se slutningen af denne medicinvejledning for en komplet liste over ingredienser i Soliqua 100/33. Symptomer på en alvorlig allergisk reaktion med Soliqua 100/33 kan omfatte:
- Hævelse af ansigtets læber tunge eller hals
- besvime eller føle sig svimmel
- problemer med at trække vejret eller sluge
- Meget hurtig hjerteslag
- Alvorligt udslæt eller kløe
- Lavt blodtryk
Før du bruger Soliqua 100/33, fortæl din sundhedsudbyder om alle dine medicinske tilstande, herunder hvis du:
- har eller har haft symptomer på akut pancreatitissten i din galdeblære eller en historie med alkoholisme.
- har eller har haft lever- eller nyreproblemer.
- har hjertesvigt eller andre hjerteproblemer. Hvis du har hjertesvigt, kan det blive værre, mens du tager Thiazolidinediones (TZDS).
- Har alvorlige problemer med din mave, såsom bremset tømning af din mave (gastroparese) eller problemer med at fordøje mad.
- tager visse lægemidler kaldet glucagon-lignende peptid-1-receptoragonister (GLP-1 receptoragonister).
- har haft en allergisk reaktion på en GLP-1-receptoragonistmedicin.
- er planlagt til at have operation eller andre procedurer, der bruger generel anæstesi eller dyb søvnighed (dyb sedation).
- er gravide eller planlægger at blive gravid. Det vides ikke, om Soliqua 100/33 vil skade din ufødte baby. Fortæl din sundhedsudbyder, hvis du er gravid eller planlægger at blive gravid, mens du bruger Soliqua 100/33.
- er amning eller planlægger at amme. Det vides ikke, om Soliqua 100/33 passerer ind i din modermælk. Tal med din sundhedsudbyder om den bedste måde at fodre din baby på, mens du bruger Soliqua 100/33.
Fortæl din sundhedsudbyder om alle de medicin, du tager inklusive recept og over-tæller medicin vitaminer og urtetilskud. Soliqua 100/33 kan påvirke den måde, nogle medicin fungerer på, og nogle medicin kan påvirke den måde, Soliqua 100/33 fungerer på.
Kend de medicin, du tager. Opbevar en liste over dem for at vise din sundhedsudbyder og farmaceut, hver gang du får en ny medicin.
Hvordan skal jeg bruge Soliqua 100/33?
- Læs de detaljerede instruktioner til brug, der følger med Soliqua 100/33 til instruktioner om brug af Soliqua 100/33 pen og injicering af Soliqua 100/33.
- Brug Soliqua 100/33 nøjagtigt, som din sundhedsudbyder fortæller dig at.
- Skift ikke din dosis, medmindre din sundhedsudbyder har bedt dig om at ændre din dosis.
- Din sundhedsudbyder skal lære dig, hvordan du injicerer Soliqua 100/33, før du bruger den for første gang. Hvis du har spørgsmål eller ikke forstår instruktionerne, skal du tale med din sundhedsudbyder.
- Tag Soliqua 100/33 kun 1 gang hver dag inden for 1 time før det første måltid på dagen.
- Hvis du går glip af en dosis af Soliqua 100/33, skal du tage din næste planlagte dosis på dit almindelige tidspunkt. Tag ikke en ekstra dosis eller øg din dosis for at kompensere for den ubesvarede dosis.
- Kontroller etiketten på Soliqua 100/33 pen, hver gang du giver din injektion for at sikre dig, at du bruger den rigtige medicin.
- Tag ikke mere end 60 enheder Soliqua 100/33 hver dag. 12 eller 123 contains two medicines: insulin glargine og lixisenatid. If you take too much 12 eller 123 it can cause severe kvalme og opkast. Gør ikke take 12 eller 123 with other GLP-1 receptor agonists. If you take too much 12 eller 123 call your healthcare provider or go to the nearest hospital emergency room right away.
- Brug kun Soliqua 100/33, der er klar og farveløs til næsten farveløs. Hvis du ser små partikler returnere det til dit apotek for en erstatning.
- Injekt din dosis Soliqua 100/33 under huden (subkutant) af dit mave lår eller overarm. Brug ikke Soliqua 100/33 i en insulinpumpe eller injicer Soliqua 100/33 i din vene (intravenøst).
- Skift (roter) dit injektionssted i det område, du vælger med hver dosis For at reducere din risiko for at få grober i hud eller fortykket hud (lipodystrofi) og hud med klumper (lokaliseret kutan amyloidose) på injektionsstederne.
- Gør ikke Brug det nøjagtige samme sted til hver injektion.
- Gør ikke Injekt, hvor huden har grober, er fortykket eller har klumper.
- Gør ikke Injekt, hvor huden er mørt mærket skællende eller hårdt eller i ar eller beskadiget hud.
- Gør ikke Bland Soliqua 100/33 i enhver anden type insulin eller flydende medicin inden injektion.
- Gør ikke Fjern Soliqua 100/33 fra kastet væk (engangs) forudfyldt pen med en sprøjte.
- Gør ikke reuse or share your needles with other people. You may give other people a serious infection or get a serious infection from them.
- Tjek dine blodsukkerniveau. Spørg din sundhedsudbyder, hvad dit blodsukker skal være, og hvornår du skal kontrollere dit blodsukkerniveau. Din dosis Soliqua 100/33 kan muligvis ændre sig på grund af en ændring i dit niveau af fysisk aktivitet eller træning af vægtøgning eller tab øget stress sygdomsændring i diæt eller på grund af andre medicin, du tager.
Hvad er de mulige bivirkninger af Soliqua 100/33?
12 eller 123 can cause serious side effects including:
- Se Hvad er de vigtigste oplysninger, jeg skal vide om Soliqua 100/33?
- Alvorlige allergiske reaktioner. Alvorlige allergiske reaktioner kan ske med Soliqua 100/33. Stop med at tage Soliqua 100/33 og få medicinsk hjælp med det samme, hvis du har symptomer på en alvorlig allergisk reaktion. Se Hvem skal ikke bruge Soliqua 100/33?
- Lavt blodsukker (hypoglykæmi). Din risiko for at få lavt blodsukker er højere, hvis du tager en anden medicin, der kan forårsage lavt blodsukker. Tegn og symptomer på lavt blodsukker inkluderer:
- hovedpine
- svimmelhed
- døsighed
- sved
- svaghed
- irritabilitet
- sult
- sløret vision
- Hurtig hjerteslag
- Følelse af jittery
- forvirring
- angst
Tal med din sundhedsudbyder om, hvordan du behandler lavt blodsukker.
- Nyreproblemer (nyresvigt). Hos mennesker, der har nyreproblemer, kan forekomsten af diarré kvalme og opkast medføre et tab af væsker (dehydrering), hvilket kan få nyreproblemer til at blive værre.
- Lavt kalium i dit blod (hypokalæmi).
- Hjertesvigt. At tage visse diabetespiller kaldet TZDS med Soliqua 100/33 kan forårsage hjertesvigt hos nogle mennesker. Dette kan ske, selvom du aldrig har haft hjertesvigt eller hjerteproblemer før. Hvis du allerede har hjertesvigt, kan det blive værre, mens du tager TZD'er med Soliqua 100/33. Din sundhedsudbyder skal overvåge dig nøje, mens du tager TZD'er med Soliqua 100/33. Fortæl din sundhedsudbyder, hvis du har nye eller værre symptomer på hjertesvigt, inklusive åndenød i åndenød i dine ankler eller fødder eller pludselig vægtøgning. Behandling med TZDS og Soliqua 100/33 kan muligvis justeres eller stoppes af din sundhedsudbyder, hvis du har ny eller værre hjertesvigt.
- Galdeblæreproblemer. Galdeblæreproblemer er sket hos nogle mennesker, der tager Soliqua 100/33. Fortæl din sundhedsudbyder med det samme, hvis du får symptomer på galdeblæreproblemer, der kan omfatte:
- Smerter i din øvre mave (mave)
- Gulning af hud eller øjne (gulsot)
- feber
- lerfarvet afføring
- Mad eller væske kommer ind i lungerne under operationen eller andre procedurer, der bruger generel anæstesi eller dyb søvnighed (dyb sedation). Soliqua 100/33 kan øge chancen for, at mad kommer ind i dine lunger under operationen eller andre procedurer. Fortæl alle dine sundhedsudbydere, at du tager Soliqua 100/33, før du er planlagt til at have operation eller andre procedurer.
De mest almindelige bivirkninger af Solar 100/33 inkluderer:
- lavt blodsukker (Hypoglykæmi)
- diarre
- kvalme
- Infektion i øvre luftvejsinfektion
- indelukket eller løbende næse og ondt i halsen
- hovedpine Kvalme og diarre usually happen more often when you first start using 12 eller 123.
Dette er ikke alle de mulige bivirkninger af Soliqua 100/33. Ring til din læge for medicinsk rådgivning om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare Soliqua 100/33?
- Opbevar din nye ubrugte Soliqua 100/33 pen i køleskabet ved 36 ° F til 46 ° F (2 ° C (2 ° C). Beskyt pennen mod lys.
- Efter først brug opbevar din Soliqua 100/33 pen ved stuetemperatur ikke højere end 25 ° C (25 ° C).
- Gør ikke freeze 12 eller 123 pens og do not use 12 eller 123 if it has been frozen.
- Udskift pennehætten efter hver brug for at beskytte mod lys.
- Efter første brug Brug Soliqua 100/33 pen i op til 28 dage. Kast den brugte Soliqua 100/33 pen efter 28 dage, selvom der er noget medicin tilbage i pennen.
- Gør ikke use 12 eller 123 past the expiration date printed on the carton og pen label.
- Gør ikke store the 12 eller 123 pen with the needle attached. If the needle is left on this might lead to contamination og cause air bubbles which might affect your dose of medicine.
- Se the Instructions for Use about the right way to throw away the 12 eller 123 pen.
- Opbevar din Soliqua 100/33 Pen Pen Needles og alle medicin uden for børns rækkevidde.
Generel information om sikker og effektiv anvendelse af Soliqua 100/33.
Medicin er undertiden ordineret til andre formål end dem, der er anført i en medicinguide. Brug ikke Soliqua 100/33 til en betingelse, som den ikke blev ordineret til. Giv ikke Soliqua 100/33 til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem. Du kan bede din farmaceut eller sundhedsudbyder om information om Soliqua 100/33, der er skrevet til sundhedsfagfolk.
Hvad er ingredienserne i Soliqua 100/33?
Aktive ingredienser: insulin glargine og lixisenatid
Inaktive ingredienser: Glycerol (20 mg) metacresol (2,7 mg) methionin (3 mg) zink (30 mcg) og vand til injektion USP. Hydrochlorsyre og natriumhydroxid tilsættes efter behov for at justere pH.
Brug til brug
Soliqua® 100/33
(Så -a -a -)
(Insulin glargine og lixisenatid) injektion til subkutan brug
Læs disse instruktioner omhyggeligt, før du bruger din Soliqua 100/33 pen.
Gør ikke share your 12 eller 123 pen with other people even if the needle has beenchanged. You may give other people a serious infection or get a serious infection from them.
12 eller 123 is an injectable prescription medicine that contains 2 diabetes medicines insulin glargine og lixisenatid in a SoloStar pen. The drug combination in this pen is only for the daily injection of 15 to 60 enheder of 12 eller 123. Each unit dialed contains 1 unit insulin glargine og 0.33 mcg lixisenatide.
Mennesker, der er blinde eller har andre synsproblemer, bør ikke bruge Soliqua 100/33 pen uden hjælp fra en person, der er trænet til at bruge pennen.
Vigtig information
- Kontroller etiketten på Soliqua 100/33 pen, hver gang du giver din injektion for at sikre dig, at du bruger den rigtige medicin.
- Gør ikke Brug din pen, hvis den er beskadiget, eller hvis du ikke er sikker på, at den fungerer korrekt.
- Udfør en sikkerhedstest inden hver injektion (se Trin 3: Lav en sikkerhedstest ).
- Bær altid en ekstra pen og ekstra nåle, hvis de går tabt eller holder op med at arbejde.
- Gør ikke reuse needles. Brug altid en ny steril nål til hver injektion. Dette hjælper med at stoppe blokerede nåleforurening og infektion. Hvis du genbruger nåle, får du muligvis ikke din dosis (underdosering) eller får for meget (overdosering).
- Gør ikke Brug Soliqua 100/33 i en insulinpumpe eller injicer Soliqua 100/33 i din vene (intravenøst).
- Gør ikke Bland Soliqua 100/33 i enhver anden type insulin eller flydende medicin inden injektion.
- Skift (roter) dine injektionssteder i det område, du valgte med hver dosis (se Steder at injicere ).
Lære at injicere
- Tal med din sundhedsudbyder om, hvordan du bruger Soliqua 100/33 pen, og hvordan du injicerer korrekt, før du bruger din pen.
- Bed om hjælp, hvis du har problemer med at håndtere pennen.
- Læs alle disse instruktioner, før du bruger din pen. Du får muligvis for meget eller for lidt medicin, hvis du ikke følger instruktionerne korrekt.
Brug for hjælp?
Hvis du har spørgsmål om din pen eller om diabetes, så spørg din sundhedsudbyder, gå til www.soliqua100-33.com eller ring Sanofi-Agentis på 1-800-633-1610.
Forsyninger, du har brug for:
- 1 123 100/33 pen
- 1 ny steril nål (se trin 2 Vedhæft en ny nål)
- 1 alkoholpind
- En punkteringsbestandig beholder til brugte nåle og kuglepenne (se kaste din pen væk i slutningen af denne brugsinstruktioner)
Steder at injicere
- Injicér din Soliqua 100/33 dosis nøjagtigt som din sundhedsudbyder har vist dig.
- Injicér din Soliqua 100/33 dosis under huden (subkutant) på dine overben (lår) overarme eller maveområde (mave).
- Skift (roter) dine injektionssteder i det område, du vælger for hver dosis for at reducere din risiko for at få grober i hud eller fortykket hud (lipodystrofi) og hud med klumper (lokaliseret kutan amyloidose) på injektionsstederne.
- Gør ikke Injekt, hvor huden har grober, er fortykket eller har klumper.
- Gør ikke Injekt, hvor huden er mørt mærket skællende eller hårdt eller i ar eller beskadiget hud.
Trin 1: Kontroller din pen
Tag en ny pen ud af køleskabet mindst 1 time før du injicerer. Kold medicin er mere smertefuld at injicere.
1a Kontroller navnet og udløbsdatoen på etiket på din pen.
- Sørg for, at du har den rigtige medicin. Denne pen er farvet lysegrøn med en orange injektionsknap (se det at kende dit pendiagram).
- Gør ikke Brug din pen efter udløbsdatoen på penetiketten.
1b træk pennen af.
1c Kontroller, at medicinen er klar og farveløs for næsten farveløs.
- Hvis du ser små partikler returnere det til dit apotek for en erstatning.
1D Tør gummipåden med en alkoholpind.
Hvis du har andre injektorpenne
- Det er især vigtigt at sikre, at du har den rigtige medicin, hvis du har andre injektorpenne.
Trin 2: Sæt en ny nål
- Gør ikke Genbrug nåle. Brug altid en ny steril nål til hver injektion. Dette hjælper med at stoppe blokerede nåleforurening og infektion.
- Brug kun nåle, der er beregnet til at blive brugt sammen med Soliqua 100/33. Nåle leveres separat. Hvis du ikke ved, hvilke nåle du skal bruge, så spørg din sundhedsudbyder eller apotek.
2A Tag en ny nål og skræl den beskyttende tætning af.
2b Hold nålen lige og skru den på pennen, indtil den er fast. Stram ikke stram.
2c træk den ydre nålhætte af. Hold dette til senere.
2d træk den indre nålhætte af og smid den væk.
Håndtering af nåle
- Pas på, når du håndterer nåle for at forhindre nål-stick-skade og krydsinfektion.
Trin 3: Lav en sikkerhedstest
Udfør en sikkerhedstest inden hver injektion til:
- Kontroller din pen og nålen for at sikre dig, at de fungerer korrekt.
- Sørg for, at du får den rigtige dosis.
3A Vælg 2 enheder ved at dreje dosisvælgeren, indtil dosispegeren er ved 2 -mærket.
3B Tryk på injektionsknappen helt ind.
- Når medicinen kommer ud af nålspidsen, fungerer din pen korrekt.
Hvis der ikke vises nogen væske:
- Det kan være nødvendigt at gentage dette trin op til 3 gange, før du ser medicinen.
- Hvis der ikke kommer nogen medicin ud efter tredje gang nålen kan blokeres. Hvis dette sker:
- Skift nålen (se trin 6 for at fjerne nålen og trin 2 for at fastgøre en ny nål)
- Gentag derefter sikkerhedstesten (se trin 3A).
- Gør ikke Brug din pen, hvis der stadig ikke kommer nogen medicin ud af nålspidsen. Brug en ny pen.
- Gør ikke Brug en sprøjte til at fjerne medicin fra din pen.
Hvis du ser luftbobler
- Du kan se luftbobler i medicinen. Dette er normalt, at de ikke vil skade dig.
Trin 4: Vælg dosis
- Gør ikke Vælg en dosis, eller tryk på injektionsknappen uden en nål, der er fastgjort. Dette kan skade din pen.
- Brug kun denne pen til at injicere din daglige dosis fra 15 til 60 enheder. Skift ikke din dosering, medmindre din sundhedsudbyder har bedt dig om at ændre din dosis.
- Gør ikke Brug denne pen, hvis du har brug for en enkelt daglig dosis, der er mere end 60 enheder.
- Gør ikke Brug pennen, hvis din enkelte daglige dosis er mindre end 15 enheder det sorte område i dosisvinduet som vist på billedet.
4A Sørg for, at en nål er fastgjort, og dosis er indstillet til 0.
4b Drej dosisvælgeren, indtil dosispointeren stiller op med din dosis.
- Gør ikke dial your dose by counting the clicks because you might dial the wrong dose. Always check the number in the dose window to make sure you dialed the correct dose.
- Hvis du vender forbi din dosis, kan du vende tilbage.
- Hvis der ikke er nok enheder tilbage i din pen til din dosis, stopper dosisvælgeren ved antallet af enheder, der er tilbage.
- Hvis du ikke kan vælge din fulde ordinerede dosis, skal du bruge en ny pen.
Hvordan man læser dosisvinduet
- Hver linje i dosisvinduet er lig med 1 enhed Soliqua 100/33.
- Selv tal er vist på linje med dosispegeren som vist på billedet.
30 enheder selected
Mærkelige tal vises som en linje mellem lige tal som vist på billedet.
29 enheder selected
Medicinsenheder i din pen
- Denne pen indeholder 300 enheder Soliqua 100/33, og den er beregnet til at blive brugt til mere end en dosis.
Trin 5: Injicer din dosis
Hvis du har svært ved at trykke på injektionsknappen i, skal du ikke tvinge den, da dette kan bryde din pen. Se afsnittet efter trin 5e nedenfor for at få hjælp.
5A Vælg et sted at injicere som vist på det billede, der er mærket steder at injicere.
5b skub nålen ind i din hud som vist af din sundhedsudbyder.
- Gør ikke Rør ved injektionsknappen endnu.
5c Placer tommelfingeren på injektionsknappen. Tryk derefter helt ind og hold.
- Gør ikke Tryk på injektionsknappen i en vinkel. Din tommelfinger kunne blokere dosisvælgeren fra at dreje.
5D Opbevar injektionsknappen holdt i, og når du ser 0 i dosisvinduet, tæller langsomt til 10.
- Dette vil sikre dig, at du får din fulde dosis.
5e Efter at have holdt og langsomt tæller til 10, skal du frigive injektionsknappen. Fjern derefter nålen fra din hud.
Hvis du har svært ved at trykke på injektionsknappen i:
- Skift nålen (se trin 6 for at fjerne nålen og trin 2 for at fastgøre en ny nål) derefter lave en sikkerhedstest (se trin 3).
- Hvis du stadig har svært ved at trykke på, skal du få en ny pen.
- Gør ikke Brug en sprøjte til at fjerne medicin fra din pen.
Trin 6: Fjern nålen
- Pas på, når du håndterer nåle for at forhindre nål-stick-skade og krydsinfektion.
- Gør ikke Sæt den indre nålhætte på igen.
6a greb den bredeste del af den ydre nålhætte. Hold nålen lige og guide den ind i den ydre nålhætte tilbage. Derefter skubbe fast på.
- Nålen kan punktere hætten, hvis den genindvindes i en vinkel.
6B greb og klem den bredeste del af den ydre nålhætte. Drej din pen flere gange med din anden hånd for at fjerne nålen.
- Prøv igen, hvis nålen ikke kommer fra første gang.
6c smid den brugte nål i en punkteringsbestandig beholder (Se kaste din pen væk i slutningen af denne brugsanvisning).
6D Sæt din penhætte på igen.
får clomid dig til at gå i vægt
- Gør ikke put the pen back in the refrigerator.
Brug af
- Brug kun din pen i op til 28 dage efter dens første brug.
Sådan opbevares din pen
Før første brug
- Hold nye kuglepenne i køleskabet mellem 36 ° F til 46 ° F (2 ° C til 8 ° C).
- Gør ikke freeze. Hvis du ved et uheld fryser din pen, kast den væk.
Efter første brug
- Hold din pen ved stuetemperatur op til 25 ° C (25 ° C).
- Gør ikke Sæt din pen tilbage i køleskabet.
- Gør ikke Opbevar din pen med nålen fastgjort.
- Opbevar pennen med din penhætte på.
Hold denne pen ude af synet og rækkevidde af børn.
Hvordan man plejer din pen
Håndter din pen med omhu
- Gør ikke drop your pen or knock it against hard surfaces.
- Hvis du mener, at din pen muligvis er beskadiget, skal du ikke prøve at ordne den. Brug en ny.
Beskyt din pen mod støv og snavs
- Du kan rengøre ydersiden af din pen ved at tørre den med en fugtig klud (kun vand). Blød ikke vask eller smør pennen. Dette kan skade det.
Kaster din pen væk
- Læg den brugte Soliqua 100/33 pen i en FDA-klaret skarp bortskaffelsesbeholder med det samme efter brug. Kast ikke væk (bortskaffer) Soliqua 100/33 pen i dit husholdningspass.
- Hvis du ikke har en FDA-Cleared Sharps bortskaffelsesbeholder, kan du bruge en husholdningsbeholder, der er:
- lavet af en kraftig plastik
- kan lukkes med et tæt passende punkteringsbestandigt låg uden at skarpe er i stand til at komme ud
- lodret og stabil under brug
- lækagebestandig og
- Korrekt mærket til at advare om farligt affald inde i beholderen.
- Når din Sharps -bortskaffelsescontainer er næsten fuld, skal du følge dine samfundsretningslinjer for den rigtige måde at bortskaffe din Sharps Disposal Container. Der kan være statslige eller lokale love om, hvordan du skal smide brugte nåle og sprøjter. For mere information om Safe Sharps bortskaffelse og for specifik information om Sharps bortskaffelse i den stat, du bor i, skal du gå til FDAs websted på: https://www.fda.gov/safesharpsdisposal
Denne brugsanvisning er godkendt af U.S. Food and Drug Administration.